génexpresszió alatt egy gén mRNS-be történő transzkripcióját és annak későbbi fehérjévé történő átalakítását értjük. A génexpressziót elsősorban a transzkripció szintjén szabályozzák, nagyrészt a fehérjék DNS-hez való kötődésének eredményeként. 1965-ben Francois Jacob, Jacques Monod és Andre Lwoff megosztották az orvosi Nobel-díjat munkájukért, támogatva azt az elképzelést, hogy a sejtek enzimszintjének szabályozását a DNS transzkripciója szabályozza., a transzkripció szabályozásával történik, amely indukálható vagy elnyomható. Ezek a kutatók azt javasolták, hogy az enzim termelését egy “operon” szabályozza, amely a kromoszómán lévő kapcsolódó gének sorozatából áll, amely operátorból, promoterből, szabályozó génből és szerkezeti génekből áll.
- a szerkezeti gének tartalmazzák az előállítandó fehérjetermékek kódját. A fehérjetermelés szabályozása nagyrészt az RNS-polimeráznak a transzkripált szerkezeti génhez való hozzáférésének modulálásával érhető el.,
- a promoter gén nem kódol semmit; ez egyszerűen egy DNS-szekvencia, amely az RNS polimeráz kezdeti kötőhelye.
- az operátor gén szintén nem kódoló; ez csak egy DNS-szekvencia, amely a represszor kötőhelye.
- a szabályozó gén kódja egy represszor molekula szintéziséhez, amely kötődik a kezelőhöz, és blokkolja az RNS polimerázt a szerkezeti gének átírásából.
a operátor gén a nem átírható DNS szekvenciája, amely a represszor kötőhely., Van is egy szabályozó gén, amely kódok a szintézis egy repressor molekula kalap kötődik az üzemeltető
- Példa Gerjesztett Átírás: Az E. coli baktérium három gének kódolják az enzimek, amelyek lehetővé teszik, hogy szét, illetve bontják laktózt (egy cukor tej). A promoter az a DNS-hely, ahol az RNS-polimeráz kötődik a transzkripció kezdeményezéséhez. Az enzimek azonban általában nagyon alacsony koncentrációban vannak jelen, mivel transzkripciójukat egy szabályozó gén által termelt represszor fehérje gátolja (lásd az alábbi ábra felső részét)., A represszor fehérje kötődik a kezelőhelyhez és gátolja a transzkripciót. Ha azonban laktóz jelen van a környezetben, akkor képes kötődni a represszor fehérjéhez és inaktiválni azt, hatékonyan eltávolítva a blokádot, és lehetővé téve az ezen gének szintéziséhez szükséges hírvivő RNS transzkripcióját (az alábbi ábra alsó része).

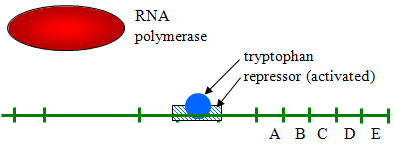
- példa az elnyomható transzkripcióra: az E. coli-nak szüksége van a triptofán aminosavra, és az E. coli DNS-nek is vannak génjei a szintéziséhez., Ezek a gének általában folyamatosan átíródnak, mivel a baktériumnak triptofánra van szüksége. Ha azonban a triptofán koncentrációja magas, akkor a transzkripciót elnyomják (kikapcsolják) azáltal, hogy egy represszor fehérjéhez kötődnek, és aktiválják az alább látható módon.
a génexpresszió ellenőrzése eukariótákban
eukarióta sejtek hasonló mechanizmusokkal rendelkeznek a génexpresszió szabályozására, de összetettebbek., Vegyük például, hogy egy adott faj prokarióta sejtjei azonosak, de a legtöbb eukarióta többsejtű organizmus, sok sejttípussal, így a génexpresszió ellenőrzése sokkal bonyolultabb. Nem meglepő, hogy az eukarióta sejtekben a génexpressziót számos összetett folyamat vezérli, amelyeket az alábbi lista foglal össze.
- a megtermékenyítés után a fejlődő embrió sejtjei egyre specializáltabbá válnak, nagyrészt bizonyos gének bekapcsolásával és sok más kikapcsolásával., Az egyes sejtek a hasnyálmirigy, például speciális szintetizálása titkos emésztő enzimek, míg a többi hasnyálmirigy sejtjei (béta-sejtek a Langerhans) vagy speciális szintézis ki inzulin. Minden típusú sejtnek van egy bizonyos expresszált génmintája. Ez a differenciálás
 speciális sejtekké nagyrészt a sejt legtöbb génjének expressziójának kikapcsolása következtében alakul ki; az érett sejtek csak a sejtmagban jelen lévő gének 3-5% – át használhatják.,
speciális sejtekké nagyrészt a sejt legtöbb génjének expressziójának kikapcsolása következtében alakul ki; az érett sejtek csak a sejtmagban jelen lévő gének 3-5% – át használhatják., - az eukariótákban a génexpresszió szabályozható a DNS csomagolásának megváltoztatásával is, amely modulálja a sejt transzkripciós enzimjeinek (pl. RNS polimeráz) a DNS-hez való hozzáférését. Az alábbi ábra azt mutatja, hogy a kromoszómák összetett szerkezettel rendelkeznek. A DNS-hélixet speciális, hisztonoknak nevezett fehérjék köré tekerjük, amelyeket szűk spirális szálakba csomagolunk. Ezek a rostok majd bukfencezett, s hajtogatott egyre kompakt szerkezet, ami, ha teljesen tekercselt, illetve sűrített, add meg a kromoszómák a jellegzetes megjelenése metafázis
 .,
.,
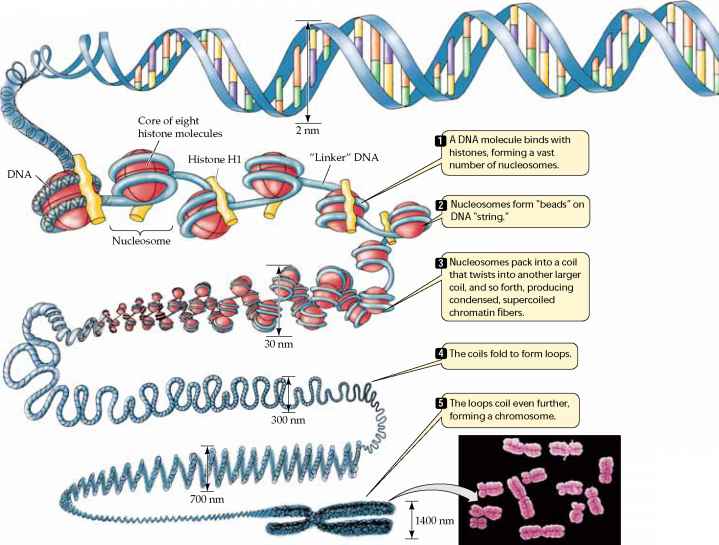
forrás:http://www.78stepshealth.us/plasma-membrane/eukaryotic-chromosomes.html
- hasonló a prokariótákhoz fent leírt operonokhoz az eukarióták szabályozó fehérjéket is használnak a transzkripció szabályozására, de minden eukarióta génnek saját kontrollcsoportja van. Emellett az eukariótákban sokkal több szabályozó fehérje van, az interakciók sokkal összetettebbek.,
- A eukaryotes átírás belül kerül sor, a membrán-kötött atommag, a kezdeti átirat módosított előtt szállítják a magot, hogy a citoplazmában a fordítás a riboszóma s. Az eredeti átirat a eukaryotes van kódolás szegmensek (exons
 ) váltakozó nem-kódoló szegmensek (intronok)., Mielőtt a mrns indul a mag, az intronok eltávolítják az átirat, amelyet a folyamat, az úgynevezett RNS-splicing (lásd a grafikus & videó alább), valamint extra nukleotid hozzá, hogy a végén a jegyzőkönyvben; ezek a nem-kódoló “sapkák”, illetve az “írás” megvédjük a mrns támadás a mobil enzimek, támogatást, elismerést, amelyet a riboszómákat.,
) váltakozó nem-kódoló szegmensek (intronok)., Mielőtt a mrns indul a mag, az intronok eltávolítják az átirat, amelyet a folyamat, az úgynevezett RNS-splicing (lásd a grafikus & videó alább), valamint extra nukleotid hozzá, hogy a végén a jegyzőkönyvben; ezek a nem-kódoló “sapkák”, illetve az “írás” megvédjük a mrns támadás a mobil enzimek, támogatást, elismerést, amelyet a riboszómákat.,
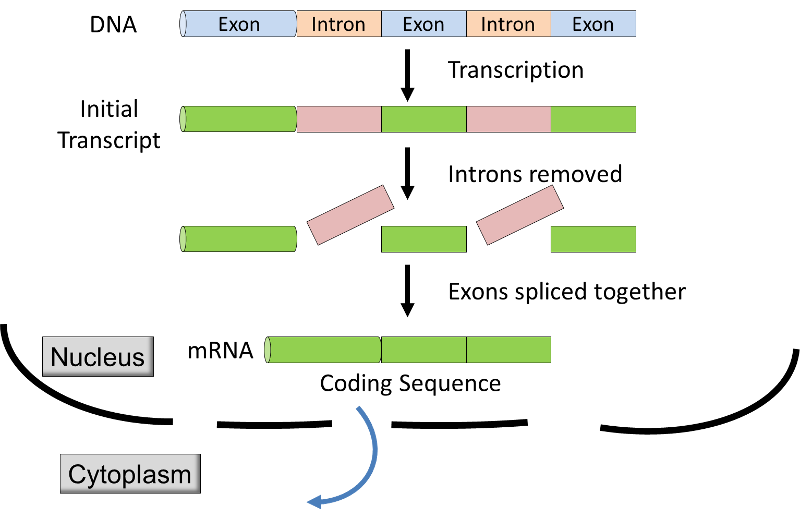
forrás:http://unmug.com/category/biology/organisation-control-of-genome/
![]()
- az mRNS hosszú élettartamának változása újabb lehetőséget kínál a génexpresszió szabályozására. A prokarióta mRNS nagyon rövid életű, de az eukarióta átiratok órákig, vagy néha akár hetekig is tarthatnak (például a madarak vörösvérsejtjeiben a hemoglobin mRNS-je).,
- a fordítási folyamat további lehetőségeket kínál számos fehérje szabályozására. Például a hemoglobin mRNS fordítását gátolják, kivéve, ha vastartalmú hem van jelen a sejtben.
- az eukariótákban lehetőség van a génexpresszió” poszttranszlációs ” szabályozására is. Néhány lefordított polipeptidet (fehérjét) enzimekkel kisebb, aktív végtermékekké vágnak. amint az az alábbi ábrán látható, amely a hormon inzulin transzlációs feldolgozását ábrázolja., Inzulin kezdetben fordítani, mint egy nagy, inaktív előfutára; jel sorrend távolítani a fejét a prekurzor, valamint egy nagy, központi részét (a C-lánc) vágott el, így két kisebb peptid láncot, amelyeket aztán egymáshoz által diszulfid hidak.A kisebb végső forma az inzulin aktív formája.
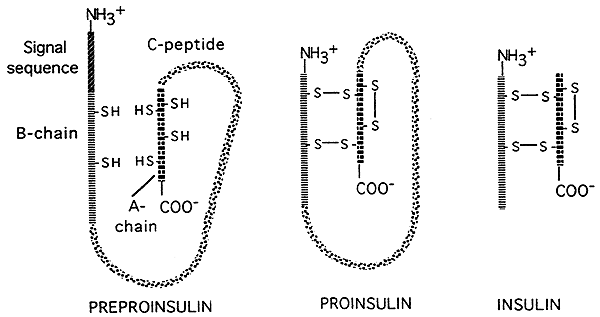
forrás:http://www.nbs.csudh.edu/chemistry/faculty/nsturm/CHE450/19_InsulinGlucagon.htm
- génexpresszió a fehérjék lebontásával is módosítható amit gyártanak., Például a sejtanyagcserében részt vevő enzimek egy része röviddel az előállításuk után lebomlik; ez egy olyan mechanizmust biztosít, amely gyorsan reagál a változó anyagcsere-igényekre.
- a gén expresszióját más sejtek jelei is befolyásolhatják. Számos példa van arra, hogy az egyik sejtből származó jelmolekula (például egy hormon) kötődik egy célsejten lévő receptor fehérjéhez, és biokémiai változások sorozatát kezdeményezi (jelátviteli út), amelyek változásokat eredményeznek a célsejten belül., Ezek a változások magukban foglalhatják a megnövekedett vagy csökkent transzkripciót, amint azt az alábbi ábra szemlélteti.
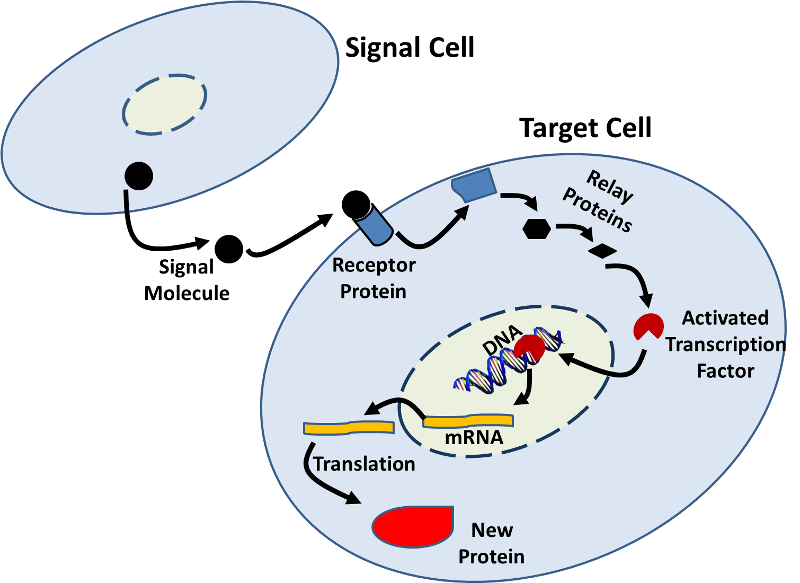
- az RNS interferencia rendszer (RNAi) egy újabb mechanizmus, amellyel a sejtek vezérlik a gén expresszióját az mRNS fordításának leállításával. RNAi is fel lehet használni, hogy állítsa le fordítását vírusfehérjék, ha egy sejt vírussal fertőzött. Az RNAi-rendszer terápiásán is kihasználható.,
RNAi
néhány RNS-vírus behatol a sejtekbe, és kettős szálú RNS-t vezet be, amely a sejteket a vírus RNS és a vírusfehérjék új példányainak előállítására használja. A sejt RNS interferenciarendszere (RNAi) megakadályozhatja a vírus RNS replikációját. Először is, a “Dicer” nevű enzim bármilyen kettős szálú RNS-t darabol, amely körülbelül 22 nukleotid hosszú darabokra talál. Ezután a RISC (RNS-indukált hangtompító komplex) nevű fehérjekomplexek kötődnek a kettős szálú RNS fragmenseihez, felforgatják, majd felszabadítják az egyik szálat, miközben megtartják a másikat., A RISC-RNS komplex ezután bármely más vírus RNS-hez kötődik, nukleotidszekvenciákkal, amelyek megegyeznek a komplexhez csatolt RNS-ekkel. Ez a kötés blokkolja a vírusfehérjék fordítását legalább részben, ha nem teljesen. Az RNAi rendszer potenciálisan alkalmazható a betegséget okozó hibás gének kezelésére. A kezelés magában foglalja, hogy egy kettős szálú RNS-a beteg gént, de bemutatkozik a sejtek, hogy elhallgattassa a kifejezése, hogy a gén., Az rnai illusztrált magyarázatát lásd a rövid, interaktív Flash modul a http://www.pbs.org/wgbh/nova/body/rnai-explained.html
az RNS interferencia rendszert az alábbi videóban a Nature Video-ból is részletesebben ismertetjük.
![]()
![]()
vissza a tetejére | Előző oldal / Következő oldal