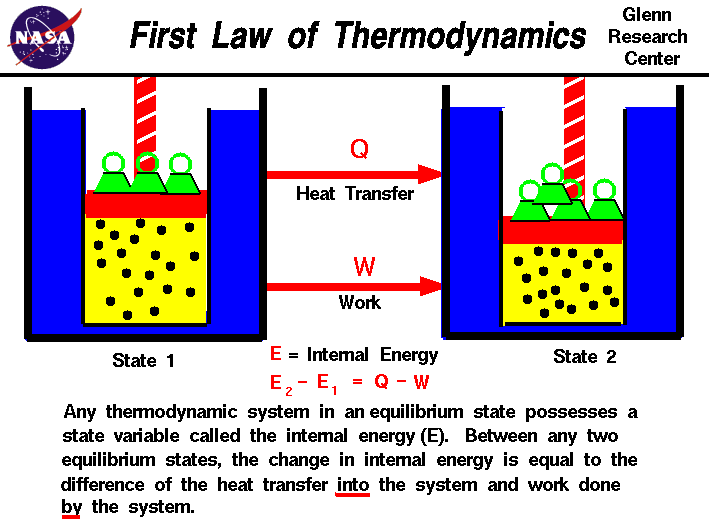
Termodinâmica é um ramo da physicswhich lida com a energia e o trabalho de um sistema.A termodinâmica lida apenas com a resposta em grande escala de um sistema que podemos observar e medir em experiências. As interações de gases em pequena escala são descritas pela teoria cinética dos gases.Existem três princípios da termodinâmica que são descritos em diapositivos separados., Cada lei conduz à definição de propriedades dinâmicas que nos ajudam a compreender e prever o funcionamento de um sistema físico. Apresentaremos alguns exemplos simples destas leis e propostas para uma variedade de sistemas físicos, embora estejamos mais interessados na termodinâmica dos sistemas de propulsão e nos fluxos de alta velocidade.Felizmente, muitos dos exemplos clássicos da termodinâmica envolvem a dinâmica dos gases.,nas nossas observações sobre o trabalho realizado, ou por um gás, descobrimos que a quantidade de trabalho não depende apenas dos estados iniciais e finais do gás, mas também do processo ou caminho que produz o estado final.Do mesmo modo, a quantidade de calor transferida para ou a partir de um gás depende também dos estados iniciais e finais e do processo que produz o estado final., Muitas observações de casos reais mostraram que a diferença entre o fluxo de calor para o gás e o trabalho realizado pelo gás depende apenas dos estadosiniciais e finais do gás e não depende do processo ou caminho que produz o estado final. Isto sugere a existência de uma variável anadicional, chamada energia interna do gás,que depende apenas do Estado do gás e não de qualquer processo.A energia interna é uma variável de Estado, assim como a temperatura ou a pressão., A primeira lei da termodinâmica define a internalenergia (e) como igual à diferença entre o sistema de transferência de calor (Q) intoa e o trabalho (W) feito pelo sistema.
E2 – E1 = Q – W
temos enfatizado a thewords “em” e “por” na definição. O calor removido de um sistema seria atribuído um sinal negativo na equação. Similarmente workdone no sistema é atribuído um sinal negativo.,a energia interna é apenas uma forma de energia como a energia potencial de um objeto a alguma Altura acima da terra, ou a energia cinética de um objeto em movimento. Da mesma forma que a energia potencial pode ser convertida em energia cinética, conservando a energia total do sistema, a energia interna de um sistema termodinâmico pode ser convertida em energia cinética ou potencial. Como a energia potencial, a energia interna pode ser armazenada no sistema.Note, no entanto, que o calor e o trabalho não podem ser armazenados ou conservados de forma independente, uma vez que dependem do processo., A primeira lei da termodinâmica permite a existência de Estados manipossíveis de um sistema, mas apenas certos estados existem na natureza. A Segunda Lei da termodinâmica ajuda a explicar esta observação.se um sistema está totalmente isolado do ambiente exterior, é possível ter uma mudança de estado em que não é transferido calor para o sistema. Os cientistas referem-se a um processo que não envolve a transferência de calor como um processo adiabático.,A implementação da primeira lei da termodinâmica para gases introduz uma outra variável de Estado útil chamada entalpia, que é descrita em uma página separada.
Atividades:
visitas Guiadas
-
 Termodinâmica:
Termodinâmica: 
Navegação ..
![]()
![]()
Beginner’s Guide Home Page