la Termodinámica es una rama de la physicswhich ofertas con la energía y el trabajo de un sistema.La termodinámica sólo se ocupa de la respuesta a gran escala de un sistema que podemos observar y medir en experimentos. Las interacciones gaseosas a pequeña escala están descritas por la teoría cinética de los gases.Hay tres principalesprincipales de la termodinámica que se describen en diapositivas separadas., Cada ley conduce a la definición de propiedades termodinámicas que nos ayudan a comprender y predecir el funcionamiento de un sistema físico. Presentaremos algunos ejemplos simples de estas leyes y propiedades para una variedad de sistemas físicos, aunque estamos más interesados en la termodinámica de los sistemas de propulsión y los flujos de alta velocidad.Afortunadamente, muchos de los ejemplos clásicos de termodinámica involucran la dinámica de gas.,
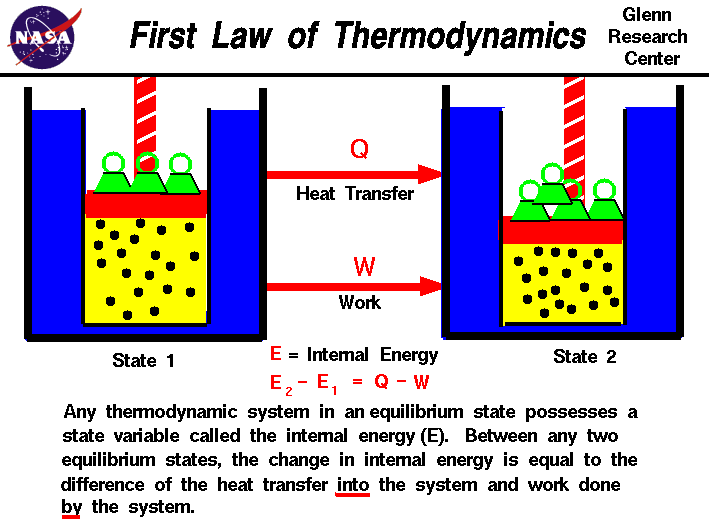
en nuestras observaciones del trabajo realizado en,o por un gas, hemos encontrado que la cantidad de trabajo no depende solo de los estados iniciales y finales del gas, sino también del proceso, o camino que produce el estado final.Del mismo modo, la cantidad de calor transferido a, o desde un gas también depende de los Estados inicial y final y el proceso que produce el estado final., Muchas observaciones de casos reales han demostrado que la diferencia del flujo de calor en el gas y el trabajo realizado por el gas depende solo de los Estados inicial y final del gas y no depende del proceso o camino que produce el estado final. Esto sugiere la existencia de una variable adicional, llamada energía interna del gas, que depende solo del estado del gas y no de ningún proceso.La energía interna es una variable de estado, al igual que la temperatura o la presión., La primera ley de la termodinámica define la energía interna (E) como igual a la diferencia de la transferencia de calor (Q) en un sistema y el trabajo (W) realizado por el sistema.
E2-E1 = Q-W
hemos enfatizado las palabras «into» y «by» en la definición. El calor eliminado de un sistema se le asignaría un signo negativo en la ecuación. Del mismo modo workdone en el sistema se le asigna un signo negativo.,
la energía interna es solo una forma de energía como la energía potencial de un objeto a cierta altura sobre la tierra, o la energía cinética de un objeto en movimiento. De la misma manera que la energía potencial puede convertirse en energía cinética mientras se conserva la energía total del sistema, la energía interna de un sistema termodinámico puede convertirse en energía cinética o potencial. Al igual que la energía potencial, la energía interna se puede almacenar en el sistema.Tenga en cuenta, sin embargo, que el calor y el trabajo no se pueden almacenar o conservar de forma independiente, ya que dependen del proceso., La primera ley de la termodinámica permite que existan muchos estados posibles de un sistema, pero solo ciertos estados se encuentran en la naturaleza. La segunda ley de la termodinámica ayuda a explicar esta observación.
si un sistema está completamente aislado del entorno exterior, es posible tener un cambio de estado en el que no se transfiere calor al sistema. Los científicos se refieren a un proceso que no implica transferencia de calor como un proceso adiabático.,La implementación de la primera ley de termodinámica para gases introduce otra variable de Estado útil llamada entalpía que se describe en una página separada.
Actividades:
Visitas Guiadas
-
 Termodinámica:
Termodinámica: 
Navegación ..
![]()
![]()
![]()
Guía del Principiante Página de Inicio