열역학의 한 분 physicswhich 에너지와 그 작업의 시스템입니다.열역학은우리가 관찰 할 수있는 시스템의 큰 규모의 응답 및 실험에서 측정. 소규모 가스 상호 작용은가스의 운동 이론에 의해 설명된다.별도의 슬라이드에 설명 된 열역학의 세 가지 원칙이 있습니다., Eachlaw 는 thermodynamic propertieswhich 는 우리가 이해하고 physicalsystem 의 작동을 예측하는 데 도움이 정의에 이르게. 우리는 것이 존재하는 몇 가지 간단한 예제는 이러한 법 andproperties 의 다양한 물리적인 시스템 althoughwe 에 가장 관심이 있습니다 열역학 ofpropulsion systemsandhigh 속가 흐른다.다행히도 많은 열역학의 고전적 예는 가스 역학을 포함합니다.,
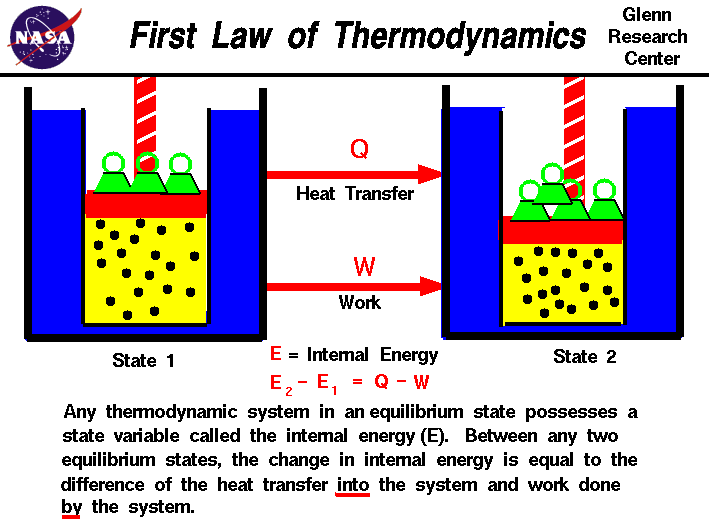
에 우리의 관찰에 대해 수행된 작업 또는 가스에 의해,우리는 우리의 양을 작업에 따라 달라집하지 않 onlyon 은 최초 및 최종국의 gasbut 또한 프로세스에,또는 경로는 생산 최종 상태입니다.마찬가지로 전송 된 열의 양,또는가스 또한 초기 및 최종 상태 및 최종 상태를 생성하는 프로세스에 따라 달라집니다., 많은 관측 realgases 과는 차이의 열 흐름으로 gasand 에 의해 수행 된 작업의 가스에 따라 초기 및 finalstates 의 가스에 의존하지 않는 프로세스 또는 pathwhich 생산 최종 상태입니다. 이 제안의 존재 anadditional 변수라는 내부에너지의 가 달려있는 상태에스지에 어떤 과정입니다.내부 에너지는 온도 또는압력과 마찬가지로 상태 변수입니다., 첫 번째 열역학 법칙을 정의합 internalenergy(E)로와 같이 열전달(Q)intoa 시스템과 작업(W)에 의해 수행 하는 시스템입니다.
E2-E1=Q-W
우리는 정의에서”into”와”by”라는 단어를 강조했습니다. 시스템에서 제거 된 열수식에서 음수 부호를 할당해야합니다. 마찬가지로 작업시스템에 음수 기호가 할당됩니다.,
내 에너지는 에너지의 형태와 같은 potentialenergy 개체의 일부에서 높이 지구 위 또는 kineticenergy 체의 움직이고 있습니다. 는 방법과 동일하게 잠재적인 energycan 로 변환되는 운동 에너지 보존하면서 총 energyof 시스템,내부에너지의 열역학적 시스템을 수 있습 beconverted 하나 운동 또는 잠재적 에너지이다. Potentialenergy 같이,내부 에너지는 체계에서 저장될 수 있습니다.그러나 열과작업은 프로세스에 의존하기 때문에 독립적으로 저장하거나 보존 할 수 없습니다., 첫 번째 열역학 법칙을 허용 manypossible 국 시스템의 존재,하지만 특정 국 arefound 에 존재하는 자연이다. Thesecond lawof thermodynamics 는이 관찰을 수행하십시오.
시스템이 외부 환경으로부터 완전히 절연 된 경우시스템으로 열이 전달되지 않는 상태의 변화가 가능합니다. 과학자들은 단열 과정으로 열 전달을 포함하지 않는 과정을 언급합니다.,최초의 구현을 열역학 법칙 가스에 대한 소개 anotheruseful 상태 변수라는 enthalpywhich 에서 설명한 별도의 페이지입니다.
활동:
가이드 투어는
 열역학:
열역학:
탐색..
![]()
![]()
![]()
초보자 가이드 홈 페이지