Fertigkeiten zu Entwickeln,
- Verstehen, warum Lavoisier wird manchmal als „Vater der Modernen Chemie“
- Unterscheiden Genauigkeit von Präzision
Also, was passiert Alchemie, die war wie die Magische Trank-brauen in Harry Potter, in der Chemie? Es war Messung. Sorgfältige, sorgfältige Messung von Größen wie Massen, Volumina, Dichten, Temperaturen, Drücken.
Ein früher held der Messung war Antoine Lavoisier., Er war einer der ersten echten Chemiker. Er führte sorgfältige Experimente durch und versuchte, keine Schlussfolgerungen zu ziehen, außer denen, die von seinen Daten verlangt wurden. Er sagte, Tatsache, Idee und Wort sollten so eng wie möglich miteinander verbunden sein: dass Sie Ihre Sprache nicht verbessern können, ohne Ihr Denken zu verbessern, und Sie können Ihr Denken nicht verbessern, ohne Ihre Sprache zu verbessern. So war er Pionier einer systematischen chemischen Nomenklatur, die im Wesentlichen das ist, was wir heute verwenden., Bemerkenswerterweise ist vieles davon nach modernen Maßstäben immer noch vollkommen verständlich und sogar korrekt, wenn Sie seinen 1789 geschriebenen Text lesen, der Anfängern die Chemie näher bringen soll.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier beschreibt zunächst die Zustände der Materie: Gase, Flüssigkeiten und Feststoffe. Er weist darauf hin, wenn ein festes Material erhitzt wird, neigt es dazu, sich auszudehnen und wird zuerst zu einer Flüssigkeit, die ein konstantes Volumen einnimmt, aber im Gegensatz zu einem Feststoff gegossen werden kann., Mehr Erwärmung, und es wird ein Gas, das er als elastisch beschreibt, weil es sich je nach Druck auf unterschiedliche Volumina ausdehnt oder komprimiert. Im Gegensatz zu den griechischen Philosophen verstand er, dass dies eine physikalische Veränderung ist, keine chemische Veränderung, und er hat eine gute submikroskopische Intuition dessen, was passiert: Die Teilchen des Materials verändern sich nicht, sie kommen nur weiter auseinander.,
Er verbrannte Schwefel und Phosphor und Kohle (Kohlenstoff) und machte sorgfältige Beobachtungen, oft mit dem Glockenglas über einem Eimer Quecksilber, wie in der Zeichnung aus seinem Buch gezeigt, Abbildung 1. Dies ist ein Beispiel für eine chemische Veränderung oder chemische Reaktion, bei der reaktante Chemikalien zu verschiedenen Produktchemikalien werden. Wenn Sie den Schwefel in der mit D gekennzeichneten Schüssel unter dem Glockenglas anzünden, brennt er, bis er erlischt und etwas zusätzlichen Schwefel zurückbleibt. Die im Glas verbleibende Luft ist nicht mehr gut zum Atmen. Wenn Sie eine Maus in das Glas geben, stirbt sie genauso wie die Flamme., Dies zeigt das Konzept der Begrenzung des Reaktanten. Die Reaktion oder das Brennen stoppte, als ihm der Sauerstoff ausging, und hinterließ hauptsächlich Stickstoff (und einige Spuren anderer Gase) im Glas. Priestley, ein anderer Wissenschaftler, zeigte ihm, wie man reines Sauerstoffgas herstellt, und er benutzte dies auch, um viele brennende Experimente durchzuführen.
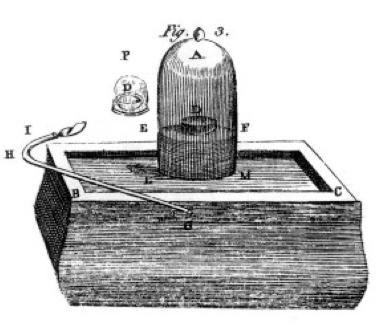
Lavoisier war besessen von der Messung., Er entwickelte aufwendige Apparate zur Messung von allem. Er würde Phosphor verbrennen, wie in Abbildung 1 gezeigt, und die Bildung eines weißen flockigen Produkts beobachten. Der Phosphor (in diesem Fall der Reaktant) war nicht wasserlöslich, aber das Produkt war, also sammelte er das Produkt sehr sorgfältig und trennte es durch Waschen mit Wasser vom nicht umgesetzten Phosphor. Nach dem Trocknen konnte er messen, wie viel Phosphor verbrannt war, wie viel Sauerstoff verbraucht worden war (weil er die Dichte des Sauerstoffgases kannte) und wie viel Produkt sich gebildet hatte., Er fand heraus, dass die Masse des Produkts die Summe der Massen des Reaktanten war, die in jedem Experiment verbraucht wurden. Dies ist das Gesetz der Erhaltung der Masse (das tatsächlich auch einige frühere Alchemisten und Chemiker verwendet hatten). Er beobachtete auch, dass der Phosphor keinen Geschmack hat, aber das Produkt, das er Phosphorsäure nannte, ist sauer. Er wusste aus diesen Experimenten, dass sich Elemente in vielen Fällen nur in bestimmten Anteilen verbinden und dass Sauerstoff sich in zwei verschiedenen Verhältnissen mit Schwefel, Phosphor usw. kombinieren kann., Er gab uns die Terminologie, die wir heute noch verwenden: Schwefelsäure besteht aus Schwefel und mehr Sauerstoff, Schwefelsäure besteht aus Schwefel und weniger Sauerstoff. – ous bedeutet weniger Sauerstoff; – ic bedeutet mehr Sauerstoff. Siehe die Nomenklatur-Seite für Details.
Lavoisier achtete sehr auf Genauigkeit und Präzision. Zum Beispiel hat er in dem soeben beschriebenen Experiment das Gasvolumen im Glockenglas vor und nach der Reaktion gemessen, aber festgestellt, dass Sie nach der Reaktion warten müssen, bis die Temperatur wieder auf das Niveau zurückkehrt, das Sie ursprünglich gemessen haben., Wenn das Gas heiß ist, wenn Sie sein Volumen nach der Reaktion messen, hat es sich ausgedehnt und Ihre Standarddichte gilt nicht. Dies würde einen systematischen Fehler in die Messungen einführen: Jedes Mal, wenn Sie das Experiment durchführen, werden Sie denken, dass mehr Gas übrig ist, als tatsächlich vorhanden ist, und Ihre Messung wird nicht genau sein. Wenn das durchschnittliche Ergebnis Ihres Experiments nahe dem korrekten Wert liegt, ist es genau. Wenn Ihr Experiment jedoch jedes Mal sehr unterschiedliche Zahlen liefert, auch wenn der Durchschnitt korrekt und das Experiment genau ist, ist es nicht genau., Präzision ist der Unterschied zwischen Treffen „um 2 Uhr“ und Treffen „um 3 Minuten und 27 Sekunden vor 14 Uhr.“Präzision ist, wie spezifisch Sie sind, wie viele Details Sie verwenden. Lavoisier half auch bei der Entwicklung des Systems von Einheiten (kg, L, m), die derzeit in Korea und vielen anderen Ländern verwendet werden.

Insgesamt hat er zwar nicht sehr viele originelle Experimente durchgeführt, die noch niemand zuvor gemacht hatte, aber er hat seine Experimente sehr sorgfältig durchgeführt, so dass sie so genau und präzise wie möglich waren, und dann hat er über sie nachgedacht klar und erstellt Wörter, um die Chemikalien und Ideen zu beschreiben, die dazu beigetragen haben, alles klarer zu machen., Wenn Sie ein Chemielehrbuch lesen, das vor Lavoiser geschrieben wurde, werden Sie sehr verwirrt sein, da die Namen für Chemikalien auf der Geschichte basieren (und so klingen würden, als kämen sie von Harry Potter), anstatt darauf zu basieren, was die Chemikalien sind. Wenn Sie einen nach Lavoiser geschriebenen Chemietext lesen, erkennen Sie die Sprache als ähnlich wie heute.
Zusammenfassung
Genauigkeit beschreibt, wie nahe ein Messwert dem tatsächlichen Wert ist. Präzision beschreibt, wie gut eine Gruppe von Messwerten miteinander übereinstimmt., Das Gesetz der Erhaltung der Masse besagt, dass Materie weder durch einen chemischen oder physikalischen Prozess geschaffen noch zerstört werden kann. Dies führt dazu, dass die Summe der Massen des Reaktanten, die in jedem Experiment verbraucht werden, gleich der Masse des Produkts ist. Chemische Veränderungen beinhalten die Änderung der chemischen Identität einer Substanz, so dass neue Substanzen gebildet werden. Physikalische Veränderungen beinhalten die Veränderung einer Substanz, ohne ihre chemische Identität zu ändern. Verbrennung und Rost sind zwei Beispiele für chemische Prozesse, während Kochen und Schmelzen Beispiele für physikalische Prozesse sind., Chemische Reaktionen beinhalten die Umwandlung von Reaktanten, Chemikalien, die im Prozess des chemischen Wandels verbraucht werden, in Produkte, Chemikalien, die durch den Prozess des chemischen Wandels produziert werden und eine andere Zusammensetzung als die Reaktanten haben. Ein limitierender Reaktant bestimmt oder begrenzt die Menge an Produkt, die aus einer chemischen Reaktion hergestellt werden kann.
externen Link
- CrashCourse Chemie: Das Grundgesetz (11 min)
Mitwirkende und Aufgaben
-
Emily V Eames (City College of San Francisco)