The chemical element hafnium is classed as a transition metal . It was discovered in 1923 by Georg von Hevesy and Dirk Coster.

Data Zone
| Classification: | Hafnium is a transition metal |
| Color: | silvery |
| Atomic weight: | 178.,49 |
| State: | solid |
| Melting point: | 2230 oC, 2503 K |
| Boiling point: | 4600 oC, 4873 K |
| Electrons: | 72 |
| Protons: | 72 |
| Neutrons in most abundant isotope: | 108 |
| Electron shells: | 2,8,18,32,10,2 |
| Electron configuration: | 4f14 5d2 6s2 |
| Density @ 20oC: | 13.,2 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 13.6 cm3/mol |
| Structure: | hcp: hexagonal close pkd |
| Hardness: | 5.5 mohs |
| Specific heat capacity | 0.14 J g-1 K-1 |
| Heat of fusion | 27.2 kJ mol-1 |
| Heat of atomization | 621 kJ mol-1 |
| Heat of vaporization | 575.,0 kJ mol-1 |
| 1st ionization energy | 658.5 kJ mol-1 |
| 2nd ionization energy | 1440 kJ mol-1 |
| 3rd ionization energy | 2250 kJ mol-1 |
| Electron affinity | 178 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 1.,3 |
| Polarisierbarkeit Volumen | 16.,none |
| Oxide(s) | HfO2 |
| Hydride(s) | HfH2 |
| Chloride(s) | HfCl4 |
| Atomic radius | 155 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 23.,2 W m-1 K-1 |
| Elektrische Leitfähigkeit | 3,4 x 106 S m-1 |
| Einfrieren/Schmelzpunkt: | 2230 oC, 2503 K |

Hafnium Metall ist Silber Farbe. Es erscheint normalerweise ziemlich grau wegen der Oxidschicht, die es in der Luft bildet. Hafniumpulver, ohne die Oxidschicht, kann sich an der Luft spontan entzünden. Bild. – Ref., (1)
Die Entdeckung von Hafnium
Die Existenz von Hafnium wurde ursprünglich vom russischen Chemiker Dmitri Mendeleev vorhergesagt. In seinem 1869 erschienenen Buch“ Das periodische Gesetz der chemischen Elemente “ sagte er die Existenz eines Elements mit ähnlichen Eigenschaften voraus, das jedoch schwerer als Titan und Zirkonium war.
1911 dachte Georges Urbain, der Entdecker des Seltenerd-Lutetiums, er habe Element 72 während seiner Spektralanalyse seltener Erden entdeckt. Er nannte dieses neue Element Celtium, aber drei Jahre später wurde gezeigt, dass es eine Mischung aus bereits entdeckten Lanthaniden ist., (2)
1921 schlug Neils Bohr dem ungarischen Chemiker Georg von Hevesy vor, nach dem fehlenden Element in Zirkoniumerzen zu suchen. (3) Nach Bohrs Quantentheorie der Atomstruktur hätten diese Metalle ähnliche chemische Eigenschaften, so dass eine gute Chance bestehe, dass sie in denselben Erzen gefunden würden.
Nach Bohrs Rat entdeckten Hevesy und der niederländische Physiker Dirk Coster Hafnium 1923 mithilfe der Röntgenspektroskopie zur Analyse von Zirkoniumerzen.
Anton Eduard van Arkel und Jan Hendrik de Boer entdeckten 1925 ein Verfahren zur Herstellung von hochreinem Hafnium., Hafniumtetraiodid (HfI4) wird auf einem weißen heißen Wolframfaden zersetzt, wodurch ein Kristallstab aus reinem Hafnium entsteht. Dies wird als Crystal Bar-Prozess bezeichnet.
Das Element wurde Hafnium nach dem lateinischen Namen „Hafnia“ genannt, was Kopenhagen bedeutet, die Stadt, in der das Element entdeckt wurde.

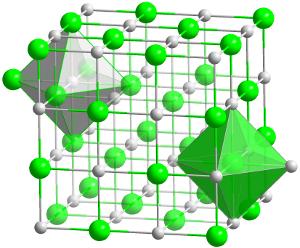
Kristallstruktur von Hafniumcarbid (HfC)., Dies ist die feuerfesteste (hitzebeständigste) Verbindung, die von zwei beliebigen Elementen im Verhältnis 1:1 bekannt ist.

Hafnium wird in Steuerstäben von Kernreaktoren in Atom-U-Booten verwendet

Weißes Hafniumoxid (IV) (HfO2). Verbindungen auf Hafniumoxidbasis werden in Siliziumchips eingeführt, um kleinere Hochleistungsprozessoren mit verbesserter Energieeffizienz herzustellen.,
Aussehen und Eigenschaften
Schädliche Wirkungen:
Hafnium gilt als ungiftig. In Pulverform ist es pyrophorisch (kann sich spontan entzünden).
Eigenschaften:
Hafnium ist ein glänzendes, silbriges, duktiles Metall.
Chemisch ähnelt es Zirkonium.
Wenn Hafnium in Verbindungen vorhanden ist, existiert es meist im Oxidationszustand IV.
Hafnium widersteht Korrosion aufgrund der Bildung eines Oxidfilms auf freiliegenden Oberflächen.
Es ist von allen Säuren (außer Fluorwasserstoff) und allen Laugen unberührt.,
Hafnium reagiert mit den Halogenen zu Tetrahalogen und reagiert bei hohen Temperaturen mit Kohlenstoff, Bor, Stickstoff, Sauerstoff, Silizium und Schwefel.
Verwendung von Hafnium
Hafnium wird aufgrund seiner Fähigkeit, Neutronen zu absorbieren, und seiner guten mechanischen und korrosionsbeständigen Eigenschaften für Steuerstäbe von Kernreaktoren verwendet. Dies steht in völligem Gegensatz zu Zirkonium, das zwar chemisch Hafnium sehr ähnlich ist, aber sehr schlecht Neutronen absorbiert., Zirkonium wird daher in der Verkleidung (Außenschicht) von Brennstäben verwendet, durch die es wichtig ist, dass Neutronen leicht wandern können.
Hafnium wird auch in fotografischen Blitzlampen, Glühbirnenfilamenten und in elektronischen Geräten als Kathoden und Kondensatoren verwendet.
Hafniumlegierungen mit mehreren anderen Metallen, wie Eisen, Niob, Tantal und Titan.
Hafnium-Niob-Legierungen sind beispielsweise hitzebeständig und werden in Luft-und Raumfahrtanwendungen wie Raumfahrt-Raketentriebwerken eingesetzt.,
Hafniumcarbid wird aufgrund seiner feuerfesten Eigenschaften zur Herstellung von Hochtemperaturöfen / – öfen verwendet (es schmilzt nicht bei hohen Temperaturen).
Hafnium-basierte Verbindungen werden in Gate-Isolatoren in der 45 nm Generation integrierter Schaltungen für Computer eingesetzt.
Verbindungen auf Hafniumoxidbasis werden in Chips auf Siliziumbasis eingebracht, um kleinere, energieeffizientere und leistungsstärkere Prozessoren herzustellen (4).
Fülle und Isotope
Fülle Erdkruste: 3,3 Teile pro Million Gewicht, 0.,4 teile pro Million nach Molen
onnensystem: 1 Teil pro Milliarde nach Gewicht, 0,01 Teile pro Milliarde nach Molen
Kosten, rein: $120 pro 100g
Kosten, bulk: $ pro 100g
Quelle: Hafnium wird in der Natur nicht frei gefunden, kommt aber in den meisten Zirkoniummineralien in einer Konzentration zwischen einem und fünf Prozent vor. Kommerziell wird Hafnium als Nebenprodukt der Zirkoniumveredelung hergestellt. Dies geschieht nach dem Kroll-Verfahren, wobei das Tetrachlorid mit Magnesium oder Natrium reduziert wird.,

- Foto von Deglr6328
- Per Enghag, Encyclopedia of the Elements: Technical Data – History – Processing – Anwendungen, 2008, John Wiley & Söhne, p527.
- Bob Weintraub, George De Hevesy (1885 1966) (pdf-Dokument).
- Aile Tamm, Atomic Layer Deposition Of High-Permittivität Isolatoren Aus Cyclopentadienyl-Basierten Vorläufer, 2010, Tartu University Press, p18.,
Zitieren Sie diese Seite
Für die Online-Verknüpfung kopieren und fügen Sie bitte eine der folgenden ein:
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium</a>
oder
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte das folgende MLA-konforme Zitat:
"Hafnium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hafnium.html>.