Einführung
Das polyzystische Ovarialsyndrom (PCOS) ist eine der häufigsten Störungen der Endokrinologie bei Frauen im gebärfähigen Alter. PCOS wird diagnostiziert, indem das Vorhandensein von zwei der folgenden Faktoren bestätigt wird: Oligo – und/oder Anovulation, klinischer und/oder biochemischer Hyperandrogenismus und Ultraschallmerkmale polyzystischer Eierstöcke unter Ausschluss anderer Ätiologien (Fr und Tarlatzis, 2004)., Die Prävalenzraten von PCOS hängen von den verwendeten diagnostischen Kriterien ab, können jedoch bei Verwendung der Rotterdam diagnostic criteria bis zu 18% betragen (Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group, 2004). Hyperandrogenismus tritt bei 60-80% der Frauen mit PCOS auf (Azziz et al., 2006). Die wichtigsten klinischen oder biochemischen Merkmale von Hyperandrogenismus sind Akne, Hirsutismus, Alopezie und seborrhoische Dermatitis; erhöhte Testosteron -, Androstendion-und Dehydroepiandrosteronsulfatspiegel; und verringerte Sexualhormon-Bindungs-Globulin (SHBG) – Spiegel., Das Syndrom zeigt nicht nur reproduktive Manifestationen, sondern hat auch metabolische Auswirkungen wie Insulinresistenz, Dyslipidämie, Fettleibigkeit, Typ-2-Diabetes und systemische Entzündungen (Deugarte et al., 2005; Sartor und Dickey, 2005; Escobar-Morreale et al., 2011).
Während die Erstlinienbehandlung zur Ovulationsinduktion bei Frauen mit PCOS die Verabreichung von Clomiphencitrat ist, wird angenommen, dass die antiöstrogenen Wirkungen von Clomiphencitrat auf das Endometrium und den Zervixschleim eine niedrige Empfängnisrate von 20% verursachen (Gonen und Casper, 1990)., Clomiphencitrat ist auch mit einer Reihe von Nebenwirkungen verbunden, einschließlich Hitzewallungen, Brustbeschwerden, Bauchdehnung, Übelkeit, Erbrechen, Nervosität, Kopfschmerzen, Haarausfall und Sehstörungen (Legro et al., 2007a). Jüngste Studien haben die Rolle von Metformin als insulinsensibilisierendes Mittel untersucht, und obwohl seine Verwendung zunimmt, ist das Verständnis seines Mechanismus unvollständig (Legro et al., 2007b)., Darüber hinaus kann es zur Entwicklung mehrerer Follikel sowie zum Risiko einer Überstimulation der Eierstöcke, Mehrlingsschwangerschaften und angeborenen Fehlbildungen wie Neuralrohrdefekten führen, was zu möglicherweise unbefriedigenden Behandlungsergebnissen führt.
Da PCOS als multifaktorielle metabolisch-endokrine Störung definiert ist (Laven et al., 2002), Lebensstil und Ernährung sowie insbesondere die Mittelmeerdiät neben der pharmakologischen Behandlung eine relevante Rolle spielen (Barrea et al., 2019)., Jüngste Studien haben gezeigt, dass ergänzende und alternative Behandlungen, einschließlich pflanzlicher Arzneimittel und Akupunktur, PCOS-Symptome lindern können, der Nachweis ihrer Wirksamkeit und Sicherheit jedoch unzureichend ist. Daher müssen neuartige Behandlungsstrategien mit komplementären und alternativen Therapien untersucht werden, um die Behandlung von PCOS zu optimieren. In dieser Studie überprüften wir Daten über die Auswirkungen und die zugrunde liegenden Mechanismen von pflanzlichen Arzneimitteln in der Behandlung von PCOS-Modell im Labor untersucht.,
Methoden
Artikel, die bis zum 30. Juni 2018 in englischer Sprache veröffentlicht wurden, wurden in Medline (via PubMed) und EMBASE (via Elsevier) durchsucht. Die Suchbegriffe wurden in einer Kombination aus medical subject heading (MeSH) Begriffe und Ihre Synonyme. Die verwendeten Suchbegriffe waren wie folgt: UND .
Die Einschlusskriterien unserer Überprüfung umfassten Folgendes:
1. In-vitro-und In-vivo-Studien, in denen die potenziellen Auswirkungen pflanzlicher Arzneimittel auf das PCOS-Modell bewertet wurden
2., Forschung zu den Verbindungen, die aus Kräutern, einzelnen Kräuterextrakten oder Kräuterformelabkochungen isoliert wurden
3. Artikel geschrieben in Englisch
Die Ausschlusskriterien waren wie folgt:
1. Klinische Studien mit pflanzlichen Arzneimitteln für PCOS
2. Review-Artikel
3., Artikel, die die Bestandteile der Kräutermedizin nicht beschrieben; Dies war jedoch im Fall von patentierten pflanzlichen Arzneimitteln
Unter den abgerufenen Studien erlaubt, nachdem die Duplikate entfernt wurden, wurden die Titel und Abstracts überprüft, um potenziell relevante Artikel zu finden. Dann, die Volltexte der gescreent Artikel wurden überprüft, um zu bestätigen, dass sie unsere Einschlusskriterien erfüllt.,
Wir extrahierten Daten in Bezug auf pflanzliche Intervention; Zielzelle (oder Tiermodell) Verwendung; Methode der Kräuterextraktion: Verabreichungsweg; Dosierung und Perioden; und Ergebnisse der Verbindungen aus Kräutern isoliert, einzelne Kräuterextrakte und Kräuterformel Abkochungen. Basierend auf diesen Daten haben wir die Maßnahmen und Mechanismen zusammengefasst, die den positiven Auswirkungen pflanzlicher Arzneimittel auf das PCOS-Modell zugrunde liegen.
Ergebnisse
Studium Eigenschaften
In der vorliegenden übersicht haben wir insgesamt 27 Studien mit 22 pflanzliche Arzneimittel, die über Ihre Wirksamkeit auf die PCOS-Modell., Wir identifizierten zwei In-vitro-Studien, 22 In-vivo-Studien und drei Studien mit In-vitro-und In-vivo-Experimenten. Die pflanzlichen Interventionen in den 27 Studien umfassten vier aus Kräutern isolierte Verbindungen (6 Studien), neun einzelne Kräuterextrakte (11 Studien) und neun Kräuterformelabkochungen (10 Studien). Ein Flussdiagramm des Artikelauswahlprozesses ist in Abbildung 1 dargestellt.
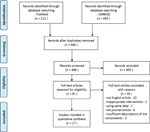
Abbildung 1 Ablaufdiagramm des Studienauswahlprozesses.,
Pflanzliche Eingriffe und ihre Laborergebnisse
Aus Kräutern isolierte Verbindungen
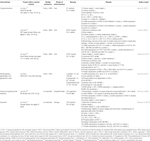
Tabelle 1 In vitro-und in vivo-Studien von Verbindungen, die aus Kräutern isoliert wurden (n=6).
Einzelne Kräuterextrakte
Aloe Vera (L.) Burm.f. reduzierte Plasmaspiegel von Gesamtcholesterin (TC), Triglycerid (TG) und Low Density Lipoprotein Cholesterin (LDL-C); erhöhte High Density Lipoprotein Cholesterin (HDL-C) Ebenen (Desai et al.,, 2012); normalisiertes Follikelwachstum; und erholte den Östrouszyklus (Maharjan et al., 2010). Atractylodes macrocephala Koidz. induzierte die Wiederherstellung des Östrouszyklus und die Verringerung des Testosteronspiegels, des Androstendionspiegels, des freien Androgenindex, des LH-Spiegels, des LH/FSH-Verhältnisses und des Anti-Müllerian-Hormonspiegels (Zhou et al., 2016). Matricaria chamomilla L.-behandelte weibliche Wistar-Ratten zeigten verminderte Zysten im Eierstockgewebe und eine erhöhte Anzahl dominanter Follikel (Zangeneh et al., 2010). Cocos nucifera L., erholte den Östrouszyklus; reduzierte TC, sehr niedrige Cholesterin-und TG-Spiegel; und erhöhte HDL-C-Spiegel (Soumya et al., 2014). Linum usitatissimum L.-behandelte weibliche SD-Ratten zeigten erhöhte Antralfollikel und Corpus luteum, eine verringerte Anzahl von zystischen Follikeln und einen verringerten Durchmesser von Antralfollikeln (Jelodar et al., 2018). Foeniculum vulgare Mill. induzierter normaler Glomerulus, normale Basalmembran und Kapillaren (Sadrefozalayi und Farokhi, 2014)., Zingiber officinale Roscoe senkte die LH-und Östrogenspiegel und erhöhte die FSH-und Progesteronspiegel bei neugeborenen weiblichen SD-Ratten (Atashpour et al., 2017). Koreanischer Roter ginseng (Panax ginseng C. A. Mey.)- behandelte SD weibliche Ratten zeigten weniger zystische Follikel und mRNA-Expression von NGF in den Eierstöcken (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata verbesserte die Glukoseinfusionsrate und reduzierte den TC – und TG-Spiegel (Mannerås et al., 2010). Die Daten sind in Tabelle 2 zusammengefasst.,
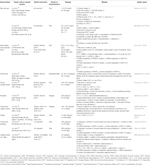
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Chinesische kräutermedizin (CHM) 1 (Wurzel Astragali Wurzel Rehmanniae Preparata, Cuscuta mich von chinesischen Lam, Obst Lebt Lucidi, Obst Psoraleae, die Wurzel von Salviae Miltiorrhizae, und himbeere Linn) und CHM 2 (Cuscuta mich von chinesischen Lam, Obst Lebt Lucidi, und himbeere Linn) induzierte erholung der östrous zyklus und die LH/FSH verhältnis, und reduktion von androstendion sollte ebenen und die freies androgen index (Gu et al., 2015)., Gui Zhu Yi Kun Formel (GZYKF) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia, und Luffa zylindrisch) reduzierte die mRNA-Expressionen von Beclin 1, leichte Kette 3, und tumor-suppressor p53 (Xing et al., 2017). HemoHIM (Angelica Radix, Cnidii Rhizoma und Paeonia Radix)-behandelte SD – Ratten zeigten eine erhöhte Anzahl und Größe von Corpora lutea und einen verringerten NGF-Proteinspiegel in den Eierstöcken (Kim et al., 2009). Es wurde festgestellt, dass Heqi san den LH – und Testosteronspiegel senkt und die Insulinresistenz mildert (Zhao et al., 2017)., Ein neuartiges pflanzliches Immunmodulatorarzneimittel (IMOD) (Rosa canina, Urtica dioica und Tanacetum vulgare)-behandelte weibliche Albino-Wistar-Ratten zeigten weniger ovarialatretische und zystische Follikel und eine höhere Anzahl von Corpora lutea (Rezvanfar et al., 2012). Die Verabreichung von Kyung-Ok-Ko (KOK) induzierte die Wiederherstellung des Östrouszyklus und des Differenzierungsclusters (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, Monozyten-Chemoattraktionsprotein (MCP)-1 und iNOS-mRNA-Expressionsreduktion in Eierstöcken weiblicher SD-Ratten (Jang et al., 2014; Lee et al., 2016)., Weibliche SD-Ratten, die mit Xiao-Yao-San (XYS) behandelt wurden (Radix bupleuri, Angelica, Radix paeoniae alba, Rhizoma atractylodis macrocephalae, Poria, Ingwer, Minze und Glycyrrhizae), zeigten eine verringerte Anzahl von zystischen Follikeln und eine verringerte terminale Desoxynucleotidyltransferase dUTP nick End Labeling (TUNEL) positive Zellen in den Antralfollikeln (Sun et al., 2017). Die Daten sind in Tabelle 3 zusammengefasst.

Tabelle 3 In-vitro-und in-vivo-Studien pflanzliche Formel Abkochungen (n=10).,
Die Wirkungen pflanzlicher Arzneimittel zur Behandlung von PCOS

Tabelle 4 Die Wirkungen pflanzlicher Arzneimittel zur Behandlung von PCOS.
Die Wirkungsmechanismen für PCOS

Tabelle 5 Die Wirkungsmechanismen pflanzlicher Arzneimittel auf PCOS.,
Diskussion
Unser Review der bis zum 30. Insgesamt vier verbindungen isoliert von Kräutern (6 Studien), neun einzelne Kräuterextrakte (11 Studien), und neun pflanzliche Formel Abkochungen (10 Studien) gefunden zu haben hemmende Effekte auf die PCOS., Den Berichten zufolge normalisierten pflanzliche Arzneimittel die weiblichen Hormone, verminderten die männlichen Hormone, erholten den Östrouszyklus, verbesserten die Insulinresistenz und verbesserten den Fettstoffwechsel. Wir fanden heraus, dass die potenzielle inhibitorische Aktivität pflanzlicher Arzneimittel verschiedene Aspekte von PCOS beeinflussen könnte, wobei die vorteilhaften Wirkungen pflanzlicher Arzneimittel hauptsächlich durch entzündungshemmende, antioxidative Belastungen, Hemmung der Autophagie oder Apoptose und ovarielle NGF-Reduktion hervorgerufen werden.,
Pflanzliche Arzneimittel können die entzündlichen Zustände von PCOS hemmen
Neuere Studien haben die Ätiologie und Pathologie von PCOS weiter untersucht. Wissenschaftler fanden heraus, dass in der Mikroumgebung von Patienten mit PCOS eine leichte chronische Entzündung ein Kennzeichen des Syndroms ist (Nestler, 2000). PCOS war bei chronischen Entzündungen relevant (Benson et al., 2008), und Makrophagen waren seine Hauptpathogenese (Wu et al., 2004). Ovarialmakrophagen produzieren Zytokine, Chemokine und Wachstumsfaktoren sowohl im normalen als auch im entzündlichen Prozess des Eierstocks., Die Makrophagen können Apoptose und Gewebeumbau orchestrieren, die an Follikulogenese, Eisprung und Bildung des Corpus luteum beteiligt sind (Benson et al., 2008). Angesichts der kritischen Rolle von Makrophagen in PCOS (Benson et al., 2008) haben zahlreiche Studien die Zytokinspiegel im Serum und in Follikelflüssigkeiten bei PCOS-Patienten verglichen. TNF-α – und IL-6-Spiegel im Serum und in Follikelflüssigkeiten waren bei nicht fettleibigen/nicht diabetischen PCOS-Patienten, die mit Gonadotrophinen behandelt wurden, erhöht (Amato et al., 2003)., Makrophagen-Entzündungsprotein-1α und MCP-1 waren bei PCOS-Patienten erhöht und mit Adipositas assoziiert (Glintborg et al., 2009). iNOS, cyclooxygenase-2 (COX-2) und transforming growth factor (TGF)-β-Aktivität erhöht wurden in den Eierstöcken von PCOS-Patienten (Elia et al., 2006; Hatzirodos et al., 2011), und die iNOS-und COX-2-Aktivität wurden durch Metformin-Verabreichung verhindert (Elia et al., 2006). Diese Ergebnisse legen nahe, dass das Immunsystem für die Pathogenese von PCOS relevant ist., Daher können neue Mittel, die auf diesen Entzündungsprozess abzielen, eine therapeutische Alternative zur aktuellen Behandlung sein.
In dieser Übersicht hemmten Iridoide signifikant die IL-1β -, IL-6 -, IL-10-und iNOS-Expression, wodurch entzündliche Zustände gehemmt wurden (Zuo et al., 2017). Quercetin reduzierte auch signifikant die Spiegel von IL-1β, IL-6 und TNF-α und verringerte die nukleare Translokation des Kernfaktors kappa B (NF-kB) in einem insulinresistenten PCOS-Rattenmodell (Wang et al., 2017)., Vor der Verabreichung von KOK verminderte die erhöhte Expression von ionisiertem Calcium-bindendem Adaptermolekül -1 ( + ) Makrophagen in der Theca-Zellschicht von Zysten und dem Stroma. KOK erhöhte auch die mRNA-Expression von CD11b und CD3 im PCOS-Eierstockgewebe. Die Präverabreichung von KOK verringerte signifikant die erhöhten Spiegel von IL-1β, IL-6, IL-8, TNF-α, MCP-1 und iNOS; und erhöhte die reduzierte mRNA-Expression von epidermalem Wachstumsfaktor und TGF-β in PCOS-Eierstöcken., Diese Ergebnisse zeigten, dass KOK die Expression von Entzündungsmediatoren im Dehydroepiandrosteron (DHEA)-induzierten PCOS-Modell reguliert (Jang et al., 2014). Entzündungsmediatoren wurden auch im Endometrium der Gebärmutter durch KOK-Verabreichung reguliert, von der gezeigt wurde, dass sie eine Endometriumhyperplasie bei PCOS-Modellen verhindert (Lee et al., 2016). Es wurde auch gezeigt, dass TNF-α im Serum und Prostaglandin E (PGE) im Eierstock durch IMODs verringert wurden (Rezvanfar et al., 2012).,
Pflanzliche Arzneimittel können oxidativen Stress in PCOS abschwächen
Reaktive Sauerstoffspezies sind wichtige Signalmoleküle bei der Regulation physiologischer Funktionen bei der weiblichen Fortpflanzung, einschließlich Steroidogenese, Follikulogenese, Eizellenreifung, Corpus luteum-Funktion und Luteolyse (Agarwal et al., 2005). Darüber hinaus spielen sie eine Schlüsselrolle in den pathologischen Prozessen der weiblichen Fortpflanzung (Agarwal et al., 2003; Agarwal et al., 2008)., Oxidativer Stress ist ein Zustand, bei dem das Gleichgewicht zwischen der antioxidativen Kapazität des Körpers und toxischen Sauerstoff – und/oder Stickstoffprodukten beeinträchtigt ist. Folglich werden freie Radikale durch zelluläre Antioxidantien nicht ausreichend entgiftet. Oxidativer Stress spielt eine wichtige Rolle bei der weiblichen Fortpflanzung (Ruder et al., 2008; Ruder et al., 2009; Vakilian et al., 2009), und es gibt zunehmend Literatur über die Auswirkungen erhöhter oxidativer Stressmarker bei unfruchtbaren Frauen und über ihre Beteiligung an der Pathophysiologie von PCOS (Joo et al., 2010; Mohamadin et al., 2010)., PCOS ist gekennzeichnet durch chronische Entzündungen, oxidativen Stress und abnormale MikroRNA-Expression (Zhao et al., 2015; Zuo et al., 2016). Da bekannt ist, dass Entzündung und oxidativer Stress eng miteinander verbunden sind, resultiert erhöhter oxidativer Stress in der Regel aus und führt zu einem entzündlichen Zustand (Zuo et al., 2016). Es ist schwierig, Entzündungen von oxidativem Stress zu trennen, und es wurde in den letzten Jahren vorgeschlagen, dass Entzündungen und oxidativer Stress die Hauptgrundlage für das Auftreten von Krankheiten bilden (Duleba und Dokras, 2012).
In dieser Rezension, IMODs (Rezvanfar et al.,, 2012) und Iridoiden (Zuo et al., 2017) zeigten positive Auswirkungen auf oxidativen/nitrosativen Stress, entweder direkt oder indirekt, hauptsächlich durch Verringerung freier Radikale und Hemmung entzündlicher Zytokine bei PCOS-Ratten. Die Verabreichung von IMODEN reduzierte signifikant die Lipidperoxidation (ein Marker für oxidativen Stress) und erhöhte Superoxiddismutase -, Katalase-und Glutathionperoxidase-Spiegel (Marker für antioxidatives Potenzial) in Hyperandrogenismus-induzierten PCOS. Darüber hinaus wurden Peroxynitrit (ein Marker für nitrosativen Stress), TNF-α und PGE-Spiegel durch IMODs signifikant reduziert., Darüber hinaus stimmten diese Wirkungen von IMODs mit histologischen Beweisen überein, die eine signifikante Verbesserung der mikroskopischen Eigenschaften der Follikulogenese im Vergleich zu denen in der Kontrollgruppe zeigten (Rezvanfar et al., 2012). Das NF-kB-Signalsystem ist als dominantes Paradigma für spezifische Signaltransduktionsmoleküle, Genaktivierung und regulatorische Proteine als Reaktion auf Entzündungen bekannt (Ivanenkov et al., 2011)., Die Iridoide dämpften effizient die Lipopolysaccharid-induzierte Erhöhung der IkB-Phosphorylierungswerte, verringerten die IkB-Expressionswerte und verringerten die NF-kB-P65, was darauf hindeutet, dass die Iridoide ihre antioxidative Wirkung über den NF-kB-Weg ausüben (Zuo et al., 2017).
Pflanzliche Arzneimittel können Apoptose und/oder Autophagie in PCOS regulieren
Das Überleben oder den Tod von Granulosazellen wird als kritischer Faktor für das Schicksal von Follikeln erkannt (Matsuda et al., 2012). Apoptose und Autophagie sind zwei Formen des programmierten Zelltodes., Autophagie ist der Prozess, bei dem ein Autophagosom, das ein Doppelmembranvesikel ist, zytoplasmatisches Material zum Lysosom transportiert (Mizushima und Komatsu, 2011). Es wurde berichtet, dass sowohl Apoptose als auch Autophagie in Granulosazellen induziert werden können und dass sie an der Kontrolle der Follikelentwicklung beteiligt sind (Choi et al., 2010; Choi et al., 2013). Granulosazellen werden als kritische Akteure in der Follikelentwicklung erkannt. Sie produzieren Estradiol, insulinähnliche Wachstumsfaktoren und andere Zytokine im Eierstock und exprimieren die Rezeptoren für Estradiol, LH und FSH (Juengel et al.,, 2006), die alle an der Regulation der Follikelentwicklung beteiligt sind. Somit kann jede Beeinträchtigung der Granulosazellen zu einer gestörten Entwicklung der Follikel führen.
Im letzten Jahrzehnt wurden autophagie-bezogene Signalwege und ihre wichtigsten Proteinregulatoren identifiziert. Das Rattenmikrotubuli-assoziierte Protein 1 light chain 3 ist mit der Autophagosommembranverarbeitung assoziiert (Kabeya et al., 2000). Es wurde auch nachgewiesen, dass Beclin-1 eine kritische Rolle bei der Bildung von Autophagosomen spielt (Von Hoven et al., 2012)., Darüber hinaus haben frühere Studien den Tumorsuppressor p53 (p53) als dualen Modulator der Autophagie bei der Regulierung des Zelltods oder Überlebens identifiziert (Vousden und Ryan, 2009; Zhang et al., 2010). Bei niedrigen Energieniveaus ist Adenosinmonophosphat-aktivierte Proteinkinase (AMPK), die durch p53 aktiviert wird, in der Lage, den tuberösen Sklerosekomplex 2 zu aktivieren und daher das Säugetierziel der Rapamycin-Aktivität (mTOR) zu hemmen und die Autophagie zu erhöhen (Feng et al., 2007)., In diesem Test aktiviert p53, das durch GZYKF im Kern aktiviert wird, wiederum AMPK und Sestrin, die als Rückkopplung in der mTOR-Hemmung wirken und dadurch die Autophagie aktivieren. Die Autophagie wird auch durch Phosphoinositid-3-Kinase/Proteinkinase B (PI3K/Akt) – Signalwege moduliert (Pyo et al., 2012). In diesem Review linderte XYS die Reduktion der Phosphorylierung von ribosomalem Protein S6 Kinase-Polypeptid I und Akt sowie die Erhöhung der Umwandlung von Mikrotubuli-assoziiertem Protein-Lichtkette 3-I in Mikrotubuli-assoziiertes Protein-Lichtkette 3-II sowohl in vivo als auch in vitro (Sun et al., 2017).,
Die Endometrien der meisten PCOS-Patienten sind dick und weisen eine einfache, komplizierte oder atypische Hyperplasie oder maligne Transformation auf, die mit der Apoptose von Endometriumzellen korrelieren kann (Villavicencio et al., 2007). Durch DHEA induzierter Hyperandrogenismus ist mit einer größeren Anzahl apoptotischer Zellen in der Endometrie assoziiert, und Metformin (ein insulinomimetisches oder insulinsensibilisierendes Mittel) kann die erhöhte Anzahl apoptotischer Zellen reduzieren (Elia et al., 2009). In dieser Überprüfung wurde der apoptotische Zelltod durch TUNEL-Färbung bewertet., Apoptotische Zellen wurden selten durch Tunelfärbung im Uterusgewebe der Schein-oder KOK-Alone-Gruppe nachgewiesen. Die Anzahl der TUNEL-positiven Zellen war jedoch in der Endometrie der DHEA-Gruppe erhöht. Die erhöhte Anzahl apoptotischer Zellen war nach Verabreichung von KOK signifikant reduziert. Diese Ergebnisse zeigen, dass die Prä-Verabreichung von KOK die DHEA-induzierte Endometriumfehlbildung hemmte, indem die Endometriumapoptose reduziert wurde (Lee et al., 2016).,
Pflanzliche Arzneimittel können den NGF-Spiegel in PCOS senken
Frühere Studien haben gezeigt, dass PCOS mit einer abnormalen Aktivierung des sympathischen Nervensystems verbunden ist, was zu erhöhten katecholaminergen Nerven führt (Semenova, 1969), gestörter Noradrenalinstoffwechsel (Garcia-Rudaz et al., 1998) und erhöhte Aktivität sympathischer Nerven über den oberen Ovarialnerv (Lara et al., 1993)., Die Entwicklung und Funktion der ovariellen sympathischen Innervation hängen vom Eierstock für die Produktion von NGF ab, einem Ziel-abgeleiteten Neurotrophin, das für die Entwicklung des peripheren sympathischen Systems benötigt wird (Levi-Montalcini, 1987). Die Neurotrophin-Familie impliziert den NGF-Rezeptor und die NGF-mRNA beim Eisprung und in der Pathophysiologie von PCOS (Lara et al., 2000; Stener-Victorin et al., 2003). In Ratten-Eierstöcken wird NGF hauptsächlich in den Zellen der Follikelwand synthetisiert (Dissen et al.,, 1996) und in PCOS kann die Aktivierung von NGF ein Faktor sein, der an der Verbesserung des Noradrenalinausflusses in die Drüse beteiligt ist, der durch Estradiolvalerat (EV) induziert wird (Lara et al., 2000) PCOS weist eine hohe intraovarielle Nervenfaserdichte auf, die mit sympathischer Hyperreaktion einhergeht (Stener-Victorin et al., 2003).
In dieser Übersicht verringerte die Verabreichung der Kräuterformeln Changbudodam-Tang und Yongdamsagan-Tang signifikant erhöhte NGF in den Eierstöcken mit geringer Wirkung auf das Hirngewebe (Lee et al., 2003)., HemoHIM normalisierte auch NGF, senkte die hohe Anzahl von Antralfollikeln und erhöhte die Anzahl von Corpora Lutea in PCOS. Diese Ergebnisse stimmen mit denen früherer Studien über die positiven Wirkungen von HämoHIM bei der Prävention und Behandlung von PCOS überein (Pak et al., 2009). Darüber hinaus Verabreichung von koreanischem rotem Ginseng-Extrakt (Pak et al., 2009; Jung et al., 2011) und koreanischen roten Ginseng insgesamt Saponine (Pak et al., 2005) signifikant verringerte die Expression von NGF-Protein und NGF-mRNA im Vergleich zu denen in EV-behandelten Eierstöcken.,
Diese Studie untersuchte die Evidenz für pflanzliche Arzneimittel, die zur Behandlung von PCOS und den damit verbundenen Symptomen verwendet werden können, und die Ergebnisse sollen das Verständnis der Wirkungsmechanismen pflanzlicher Arzneimittel in der PCOS-Behandlung verbessern. Die Hauptbeschränkung unserer Studie ist die Heterogenität der Interventionen. Darüber hinaus hat unsere Studie keine Qualitätsbewertung jeder Studie oder eine quantitative Synthese der Ergebnisse durchgeführt. Weitere Studien, die eine methodische Qualitätsbewertung und eine quantitative Synthese der Ergebnisse umfassen, sind gerechtfertigt.,
Schlussfolgerung
In dieser Übersicht zeigten insgesamt 27 Studien mit 22 pflanzlichen Arzneimitteln positive Auswirkungen auf PCOS. Pflanzliche Interventionen in den 27 Studien umfassten vier aus Kräutern isolierte Verbindungen (6 Studien), neun einzelne Kräuterextrakte (11 Studien) und neun Kräuterformelabkochungen (10 Studien). Es wurde gezeigt, dass pflanzliche Arzneimittel weibliche Hormone normalisieren, männliche Hormone verringern, den Östrogenzyklus wiederherstellen, die Insulinresistenz verbessern und den Fettstoffwechsel in PCOS verbessern., Die Mechanismen, die den positiven Wirkungen pflanzlicher Arzneimittel auf PCOS zugrunde liegen, sind mit entzündungshemmenden, antioxidativen Stress, Hemmung der Autophagie und/oder Apoptose und Ovarial NGF Reduktion verbunden. Pflanzliche Arzneimittel können als vielversprechende Ressourcen bei der Entwicklung wirksamer therapeutischer Mittel für PCOS angesehen werden.
Autor Beiträge
I-HC-und KP die Studie konzipiert. C-YK und KP durchsuchten die Artikel und analysierten die Daten. KP schrieb das Manuskript und I-HC revidierte es. Alle Autoren haben zu dem Artikel beigetragen und die eingereichte Version genehmigt.,
Finanzierung
Diese Arbeit wurde von der National Research Foundation of Korea (NRF) gefördert, die von der koreanischen Regierung (MSIP) (Nr.NRF-2017R1C1B1006387) und der Koreanischen Gesellschaft für Ginseng (2019).
Interessenkonflikt
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group (2004). Überarbeiteter Konsens von 2003 über diagnostische Kriterien und langfristige Gesundheitsrisiken im Zusammenhang mit dem Syndrom der polyzystischen Ovarien. Fertility Sterility 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Volltext / Google Scholar
Semenova, I. (1969). Adrenerge Innervation der Eierstöcke beim Stein-Leventhal-Syndrom. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar