Thermodynamik ist ein Zweig der Physikerdie sich mit der Energie und Arbeit eines Systems befassen.Die Thermodynamik beschäftigt sich nur mit der großen Skala eines Systems, das wir in Experimenten beobachten und messen können. Kleine Skala gas Interaktionen aredescribed durch die kinetische Theorie der Gase.Es gibt drei principallaws der Thermodynamik, die auf separaten Dias beschrieben werden., Jedes Gesetz führt zur Definition vonthermodynamische Eigenschaftendie uns helfen, die Funktionsweise eines physikalischen Systems zu verstehen und vorherzusagen. Wir werden einige einfache Beispiele für diese Gesetze undEigenschaften für eine Vielzahl von physikalischen Systemen vorstellen, obwohl wir am meisten an der Thermodynamik von Antriebssystemenund Hochgeschwindigkeitsströmen interessiert sind.Glücklicherweise viele derklassische Beispiele der Thermodynamik beinhalten Gasdynamik.,
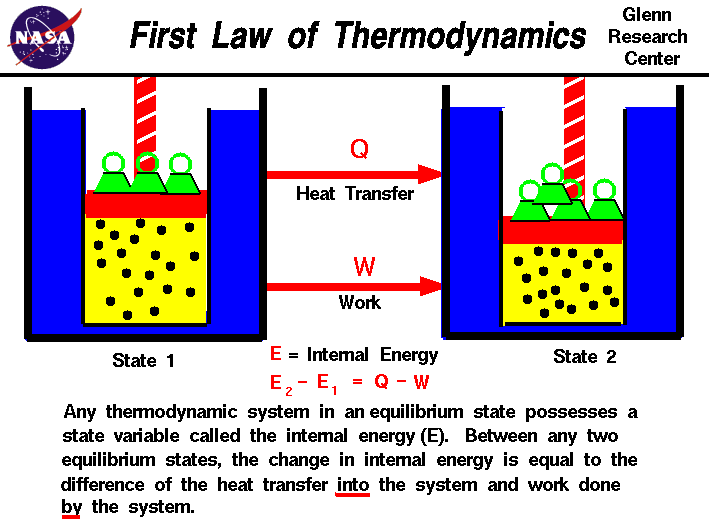
In unseren Beobachtungen der Arbeit an oder mit einem Gas haben wir festgestellt, dass der Arbeitsaufwand nicht nur vom Anfangs-und Endzustand des Gases abhängt, sondern auch vom Prozess oder Pfad, der den Endzustand erzeugt.In ähnlicher Weise hängt die Wärmemenge, die in oder aus einem Gas übertragen wird, auch vom Anfangs-und Endzustand und von dem Prozess ab, der den Endzustand erzeugt., Viele Beobachtungen von Realgasen haben gezeigt, dass der Unterschied des Wärmeflusses in das Gasund die vom Gas geleistete Arbeit hängt nur von den Anfangs-und Endzuständen des Gases ab und hängt nicht von dem Prozess oder Path ab, der den Endzustand erzeugt. Dies deutet auf die Existenz eines hinzusätzliche Variable, genannt die innere Energie des Gases,die nur vom Zustand des Gases und nicht von irgendeinem Prozess abhängt.Die innere Energie ist eine Zustandsvariable, genau wie die Temperatur oderderdruck., Der erste Hauptsatz der Thermodynamik definiert den Internenenergie (E) als gleich der Differenz der Wärmeübertragung (Q) inein System und die Arbeit (W) durch das System.
E2 – E1 = Q – W
Wir haben betont, thewords „in“ und „von“ in der definition. Wärme aus einem System entferntwürde ein negatives Vorzeichen in der Gleichung zugewiesen werden. In ähnlicher Weise workdone auf dem System ist ein negatives Vorzeichen zugeordnet.,
Die innere Energie ist nur eine Form von Energie wie die Potentialenergie eines Objekts in einer Höhe über der Erde oder die Kinetikenergie eines Objekts in Bewegung. So wie potentielle Energie in kinetische Energie umgewandelt werden kann und gleichzeitig die Gesamtenergie des Systems erhalten bleibt, kann die innere Energie eines thermodynamischen Systems entweder in kinetische oder potentielle Energie umgewandelt werden. Wie potentialenergy kann die innere Energie im System gespeichert werden.Beachten Sie jedoch, dass Wärme und Wärme nicht unabhängig voneinander gespeichert oder konserviert werden können, da sie vom Prozess abhängen., Der erste Hauptsatz der Thermodynamik erlaubt vielemögliche Zustände eines Systems zu existieren, aber nur bestimmte Zustände sind in der Natur vorhanden. Thesecond law of thermodynamics helps toexplain this observation.
Wenn ein System vollständig von der äußeren Umgebung isoliert ist, ist es möglich, einen Zustandswechsel vorzunehmen, bei dem keine Wärme in das System übertragen wird. Wissenschaftler bezeichnen einen Prozess, der keine Wärmeübertragung beinhaltet, als adiabatischen Prozess.,Die Implementierung des ersten Hauptsatzes der Thermodynamik für Gase führt eine andere einnützliche Zustandsvariable namens Enthalpiewas auf einer separaten Seite beschrieben wird.
Aktivitäten:
Führungen
-
 Thermodynamik:
Thermodynamik: 
Navigation ..
![]()
![]()
Anfängeranleitung Startseite