Ein Katalysator ist eine Substanz, die eine chemische Reaktion beschleunigt, aber nicht von der Reaktion verbraucht wird; Daher kann ein Katalysator am Ende der Reaktion chemisch unverändert zurückgewonnen werden, um ihn zu beschleunigen oder zu katalysieren.

<
Damit Chemikalien reagieren können, müssen ihre Bindungen neu angeordnet werden, da sich die Bindungen in den Produkten von denen in den Reaktanten unterscheiden.,Der langsamste Schritt in der Bindungsumlagerung erzeugt einen sogenannten Übergangszustand – eine chemische Spezies, die weder ein Reaktant noch ein Produkt ist, sondern ein Zwischenprodukt zwischen den beiden ist.
Energie wird benötigt, um den Übergangszustand zu bilden. Diese Energie wird Aktivierungsenergie oder Ea genannt.Das Lesen des Diagramms unten von links nach rechts zeigt den Fortschritt einer Reaktion, wenn Reaktanten den Übergangszustand durchlaufen, um Produkte zu werden.,
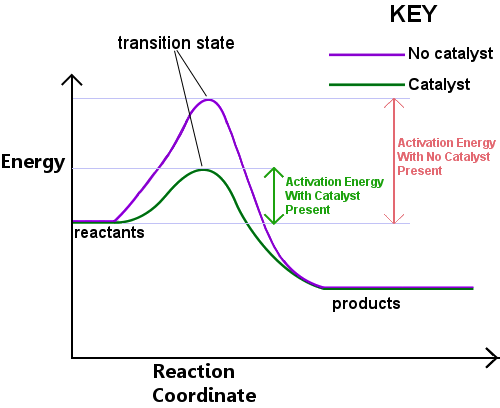
Die Aktivierungsenergie kann als Barriere für eine chemische Reaktion angesehen werden, eine Hürde, die überwunden werden muss.Wenn die Barriere hoch ist, haben nur wenige Moleküle genügend kinetische Energie, um zu kollidieren, einen Übergangszustand zu bilden und die Barriere zu überqueren.Reaktanten mit einer Energie von weniger als Ea können den Übergangszustand nicht durchlaufen, um zu reagieren und zu Produkten zu werden.
Ein Katalysator arbeitet, indem er einen anderen Weg mit niedrigerem Ea für die Reaktion bereitstellt. Katalysatoren senken die Energiebarriere.,Die unterschiedliche Route ermöglicht es, die Bindungsumlagerungen, die erforderlich sind, um Reaktanten in Produkte umzuwandeln, mit einer geringeren Energie leichter durchzuführen input.In jedes gegebene Zeitintervall, das Vorhandensein eines Katalysators ermöglicht es einem größeren Anteil der reaktanten Spezies, genügend Energie aufzunehmen, um den Übergangszustand zu durchlaufen und Produkte zu werden.
Beispiel 1: Der Haber-Prozess
Der Haber-Prozess, der zur Herstellung von Ammoniak aus Wasserstoff und Stickstoff verwendet wird, wird durch Eisen katalysiert, das atomare Stellen bereitstellt, an denen sich die Reaktantenbindungen leichter neu anordnen können, um den Übergangszustand zu bilden.,
Beispiel 2: Enzyme
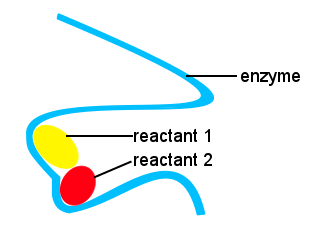
In unserem Körper, und in anderen Lebewesen, Enzyme beschleunigen biochemische Reaktionen. Ein Enzym ist eine Art Katalysator.Ein komplexes Leben wäre ohne Enzyme unmöglich, um Reaktionen mit geeigneten Geschwindigkeiten stattfinden zu lassen.Die Formen von Enzymen zusammen mit Orten auf dem Enzym, die an die Reaktanten binden, bieten einen alternativen Reaktionsweg, so dass bestimmte Moleküle zusammenkommen, um einen Übergangszustand mit einer reduzierten Aktivierungsenergiebarriere zu bilden.,
Im folgenden Schema stellt das langkettige Enzym Stellen bereit, an denen reaktante Moleküle zusammenkommen, um einen Übergangszustand mit geringer Aktivierungsenergie zu bilden.
Katalysatoren können die Position eines chemischen Gleichgewichts nicht verschieben – die Vorwärts-und Rückwärtsreaktionen werden beide beschleunigt, so dass die Gleichgewichtskonstante Keq unverändert bleibt.Durch das Entfernen von Produkten aus dem Reaktionsgemisch während ihrer Bildung kann jedoch in der Praxis die Gesamtrate der Produktbildung erhöht werden.