Stop og tænk på dine knogler: hvilke billeder kommer i tankerne? Måske et kranium med grinende kæber, eller de stærke hvide lemmer strækker sig ud mod dine fingre og tæer. Du kan endda tænke på knoglemarven i dem, der producerer blodet, der løber gennem dine årer. Men dette er ikke hele billedet, for dit skelet skjuler en hemmelighed: det er fuld af fedt, og ingen ved hvorfor.,
et uløst mysterium
dette uløste mysterium er overraskende. Forskere bemærkede først, at vores knoglemarv indeholder fedtopbevarende celler, kaldet adipocytter, for over et århundrede siden.1, og som Har adipocytter i vores knogler kan strejke dig som usædvanlig, men det er det ikke: i pattedyr, knoglemarv fedtvæv (MAT) udvikler sig støt efter fødslen og ophobes hurtigt i puberteten sådan, at ved den tid, vi når voksenalderen, det kan indeholde op til 70% af knoglemarv volumen – dette udgør over 8% af den samlede fedtmasse!,2
måtten er ikke fordelt ensartet omkring skelettet, men dominerer i stedet i arme og ben. Denne perifere måtte udvikler sig tidligt efter fødslen og er sjældent udtømt og er således blevet kaldt ‘konstitutiv måtte’ (cMAT).3 i modsætning hertil indeholder mere centrale steder, såsom rygsøjlen, bækkenet og brystbenet, såvel som mere proksimale regioner i de lange knogler, mindre MAT og mere hæmatopoietisk rød marv (se figur)., På disse steder er marvadipocytter mere diffuse og har tendens til at stige eller falde som reaktion på miljømæssige eller patologiske faktorer; derfor er dette depot blevet kaldt ‘reguleret MAT’ (rMAT).3
andre egenskaber af marv adipocytter varierer også på tværs af disse skeletsteder, med potentielle konsekvenser for måttens indvirkning på sundhed og sygdom.2,3 MAT stiger faktisk yderligere med aldring og under forskellige kliniske tilstande, herunder skelet -, metaboliske og hæmatologiske sygdomme (figur)., Derfor tiltrækker MAT nu stor interesse som en potentiel spiller i udviklingen af adskillige sygdomme. I modsætning til hvide og brune fedtvæv (henholdsvis Batat og BAT) har undersøgelsen af MAT imidlertid været relativt begrænset. Følgelig forbliver matens fysiologiske og patologiske funktioner dårligt forstået.4 Så hvad er funktionen af måtten, og hvordan kan det påvirke menneskers sundhed?
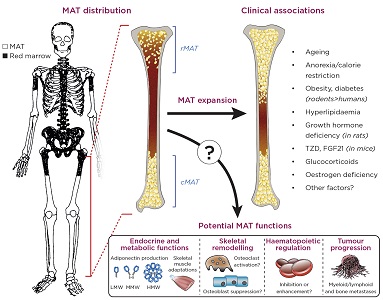
Den anatomiske fordeling, klinisk foreninger og mulige funktion af knoglemarven fedtvæv (MAT)., Billedet af skelettet er tilpasset fra Kricun (1985).16 cMAT, konstituerende MAT; rMAT, reguleret MAT; TZD, thiazolidinediones; FGF21, fibroblast growth factor 21; LMW/MMW/hellenic mining watch, lav/medium/høj molekylvægt. Kricun ME 1985 rød-gul marv konvertering: dens virkning på placeringen af nogle ensomme knogle læsioner. Skeletal radiology 14 (1), s.10-19. International International Skeletal Society 1985. Med tilladelse fra Springer.
Dårligt til knoglen?,
øget knoglemarvsadipositet (BMA) er forbundet med lavere knoglemineraltæthed og øget knogleskørhed, for eksempel ved osteoporose, aldring og østrogenmangel.5 Dette har motiveret forskning i, hvordan måtten har en indvirkning på skelet integritet.en mulighed er, at knoglemarvsadipocytter deler den samme skeletstamcelleprecursor som knogledannende osteoblaster, i hvilket tilfælde MATAKKUMULERING kan forekomme på bekostning af osteoblastudvikling.,6 selvom dette er sandt under embryonisk udvikling, er det imidlertid ikke fast etableret, hvis denne almindelige forløber fortsætter til voksen alder for at bidrage til postnatal vævsvedligeholdelse.
en anden mulighed er, at knoglemarvsadipocytter udskiller lokale faktorer, der direkte forringer knogledannelse og / eller stimulerer knogleresorption og derved øger brudrisikoen.7 interessant nok kan sådanne parakrine handlinger også fremme væksten af tumorer i knoglen, hvad enten primære myeloide/lymfoide kræftformer eller metastaser fra andre steder (figur).,8,9
er MATAKKUMULERING derfor dårlig for knoglesundhed? Desværre er det for tidligt at fortælle. Selvom øget MAT kan være forbundet med forhøjet brudrisiko, er øget MAT ikke altid forbundet med knogletab. Måttens potentielle indvirkning på udviklingen af knogletumorer skal også forstås fuldt ud. I betragtning af de folkesundhedsmæssige udfordringer, der er forbundet med osteoporose, skeletkræft og aldringsassocierede sygdomme, er det et vigtigt mål for løbende forskning at belyse disse funktioner af MAT.,
hæmatologi
den vigtigste funktion af knoglemarv er i blodcelleproduktion, så det er ikke overraskende, at mange af de tidligste undersøgelser af MAT blev forfulgt ud fra et hæmatologisk perspektiv. Generelt er nedsat BMA forbundet med øget hæmatopoiesis,10 hvilket antyder en undertrykkende virkning af MAT.et skelsættende 2009-papir, der understøtter denne mulighed, viste, at blokering af MATOPHOBNING øger hæmatopoietisk bedring efter knoglemarvstransplantation.,11 Dette har vigtige translationelle konsekvenser: mange modtagere af knoglemarvstransplantationer viser dårlig langsigtet bedring, og derfor kan undertrykkelse af marvadipogenese udgøre en ny terapeutisk tilgang.
ikke alle data understøtter imidlertid en negativ effekt på hæmatopoiesis. Faktisk antyder nyere forskning, at marvadipocytter i forbindelse med knoglemarvstransplantationer udskiller et molekyle kaldet stamcellefaktor, gennem hvilket de fremmer hæmatopoiesis og regenerering af hæmatopoietiske stamceller.,12 hvad angår de formodede virkninger af måtten på knoglen, viser dens indvirkning på hæmatopoiesis sig at være mere kompleks end først antaget (figur).
UD over KNOGLEN: METABOLISKE OG ENDOKRINE FUNKTIONER
Selv om MAT ‘ s funktioner i knogle og knoglemarv fortsat at blive endeligt etableret, synes det klart, at marv adipocytter kan påvirke skelet homøostase og haematopoiesis ved at udskille lokalt virkende faktorer. Men udskiller MAT, LIGESOMATAT, også endokrine produkter for at udøve systemiske metaboliske virkninger?
nylige undersøgelser fra vores laboratorier og andre understøtter denne mulighed., Talrige rapporter viser, at knoglemarvsadipocytter producerer leptin, det prototype adipocyt-afledte hormon, der har stor indflydelse på energihomeostase, betændelse og reproduktiv funktion.7 Vi har fundet, at, som i WAT, leptin udtryk i MÅTTEN er undertrykt i svar til nedsat kalorieindtag,13 viser, at MÅTTEN og WAT deler fælles mekanismer til at regulere deres endokrine funktioner.
hvorvidt MAT bidrager til cirkulerende leptin forbliver ukendt, men dets funktion som kilde til andre endokrine faktorer bliver klar., Et stort fokus i Vores forskning har været på MAT som en kilde til adiponectin, den anden store hormon produceret af fedtvæv. På trods af denne fedtkilde reduceres cirkulerende adiponectin i fedme og øges i tilstande med leanness, såsom under kaloribegrænsning. Selv efter 20 års omfattende forskning på adiponectin var grundlaget for dette såkaldte ‘adiponectin parado?’ forblevet ufuldstændigt forstået; hvorfor skulle et adipose-afledt hormon øges, nåratat mangler?
det var gennem denne linse, at vi begyndte at se måtten i et nyt lys., I skarp kontrast TILATAT øges MATDANNELSEN i sultetilstande, såsom under kaloribegrænsning hos dyr og hos humane patienter med anore .ia nervosa.14 både MAT og cirkulerende adiponectin øges også ved mange andre tilstande, såsom aldring, østrogenmangel og efter behandling med glukokortikoider eller anti-diabetiske lægemidler (figur).4 men er disse blot tilfældigheder, eller bidrager MAT faktisk til at cirkulere adiponectin?
for at besvare dette spørgsmål kombinerede vi kliniske observationer med studier i en unik musemodel, der modstår MATDANNELSE., Disse tilgange afslørede, at under kaloriebegrænsning kræves mat-ekspansion for de fulde stigninger i cirkulerende adiponectin,15 en konklusion siden understøttet af vores nyere forskning.4,13 MAT ekspansion under kaloriefattige begrænsning synes også at påvirke metaboliske tilpasninger inden skeletmuskulatur.15 Det er uklart, om dette er via adiponectin eller andre endokrine faktorer, men det understreger MAT ‘ s potentiale til at udøve systemiske virkninger.,
FUTURE MATTERS
i løbet af det sidste årti har det spirende felt inden for MÅTTEFORSKNING enormt avanceret vores forståelse af MÅTTDANNELSE og-funktion. MÅTTEN er ikke længere anses for en inert ‘rum fyldstof” i knoglemarven, men også et aktivt væv med forskellige konsekvenser for knoglernes remodellering, tumor progression, hæmatopoietiske forordning, og systemisk endokrine og metaboliske funktioner. Ikke desto mindre falder undersøgelsen af MAT stadig langt bagefter studyat og BAT, og derfor er der stadig mange centrale spørgsmål, der skal besvares.,heldigvis samles et bredt videnskabeligt samfund nu omkring MATFORSKNING. Det første internationale møde om BMA blev afholdt i Lille, Frankrig, i 2015, med succesfulde opfølgningsmøder i 2016 og 2017. I 2017 BMA møde i Lausanne, Schweiz, deltagere stemte for at etablere den Internationale Knoglemarv Overvægt Samfundet, som har til formål at fremme viden om BMA (www.bma-society.org). Denne udvikling fremhæve den stigende interesse og begejstring for undersøgelse af MÅTTEN., Derfor kan vi være sikre på, at den fremtidige forskningsindsats fortsat vil låse op for grundlæggende viden om MATBIOLOGI, både som et endokrint organ og videre.,
William P Cawthorn, Kansler Kolleger og MRC karriereudvikling Fellow, University/British Heart Foundation Center for Hjerte-kar-Science, University of Edinburgh, STORBRITANNIEN
Ormond En MacDougald, John En Faulkner Kollegiale Professor i molekulær-og Integrative Physiology, University of Michigan Medical School, Ann Arbor, MI, USA
- Muir R & Drummond WB 1893 Tidende Anatomi & Fysiologi 28 125-141.
- Scheller EL et al. 2016 tendenser inden for endokrinologi & metabolisme 27 392-403.,
- Scheller EL et al. 2015 Natur Kommunikation 6 7808.
- Scheller EL et al. 2016 adipocyt 5 251-269.
- Sch .art.AV 2015 grænser i endokrinologi (Lausanne) 6 40.
- Gimble JM et al. 1996 knogle 19 421-428.
- Sulston RJ & Cawthorn WP 2016 Hormon, Molekylær Biologi, Klinisk Undersøgelse, 28 21-38.
- Shafat MS et al. 2017 Blod 129 1320-1332.
- Morris EV & Edwards CM 2016 Grænser i Endokrinologi (Lausanne) 7 90.
- horo .it.MC et al. 2017 adipocyt 6 193-204.,
- Naveiras O et al. 2009 Natur 460 259-263.
- Zhou BO et al. 2017 Natur Cellebiologi 19 891-903.
- ca .thorn Cap et al. 2016 Endokrinologi 157 508-521.
- Ghali O et al. 2016 grænser i endokrinologi (Lausanne) 7 125.
- ca .thorn Cap et al. 2014 Cellemetabolisme 20 368-375.Kricun ME 1985 Skeletradiologi 14 10-19.