Habilidades para Desenvolver
- Entender por Lavoisier é às vezes chamado de “o Pai da Química Moderna”
- Distinguir a precisão de precisão
Então, o que aconteceu para transformar a alquimia, que era como poção mágica-a fabricação de cerveja em Harry Potter, a ciência da química? Era uma medida. Medição cuidadosa e cuidadosa das quantidades, tais como massas, volumes, densidades, temperaturas, pressões.
um herói inicial de medição foi Antoine Lavoisier., Foi um dos primeiros verdadeiros cientistas químicos. Ele conduziu experimentos cuidadosos, e tentou tirar nenhuma conclusão exceto aqueles exigidos por seus dados. Ele disse fato, idéia e palavra devem estar o mais estreitamente conectados possível: que você não pode melhorar a sua linguagem sem melhorar o seu pensamento, e você não pode melhorar o seu pensamento sem melhorar a sua língua. Então ele foi pioneiro em uma nomenclatura química sistemática que é essencialmente o que usamos hoje., Notavelmente, se você ler seu texto, escrito em 1789, destinado a introduzir química para iniciantes, grande parte dele ainda é perfeitamente compreensível e até correto pelos padrões modernos.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier primeiro descreve os estados da matéria: gases, líquidos e sólidos. Ele aponta que quando um material sólido é aquecido, tende a expandir-se, tornando-se primeiro um líquido, que ocupa um volume constante, mas pode ser derramado, ao contrário de um sólido., Mais aquecimento, e torna-se um gás, que ele descreve como elástico porque ele vai expandir ou comprimir para diferentes volumes, dependendo da pressão. Ao contrário dos filósofos gregos, ele entendeu que esta é uma mudança física, não uma mudança química, e ele tem uma boa intuição submicroscópica em escala do que está acontecendo: as partículas do material não mudam, eles apenas se afastam mais.,
ele queimou enxofre e fósforo e carvão vegetal (carbono) e fez observações cuidadosas, muitas vezes usando o jarro de sino sobre um balde de mercúrio como mostrado no desenho de seu livro, Figura 1. Este é um exemplo de uma mudança química ou reação química, em que produtos químicos reagentes se transformam em produtos químicos diferentes. Se acenderes o enxofre no prato com o rótulo D, sob o frasco de ar, ele arde até sair deixando algum enxofre extra. O ar que resta no frasco já não é bom para respirar. Se você colocar um rato no frasco, ele vai morrer, assim como a chama fez., Isto demonstra o conceito de reagente limitante. A reação ou queima parou quando ficou sem oxigênio, deixando principalmente nitrogênio (e alguns vestígios de outros gases) no jarro. Priestley, outro cientista, mostrou-lhe como preparar gás de oxigênio puro, e ele usou isso para fazer muitas experiências queimadas também.
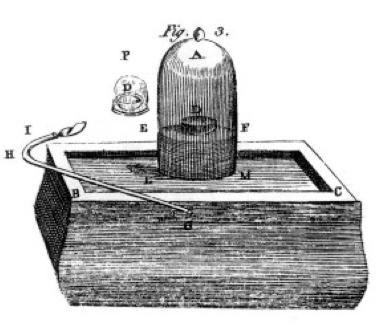
Lavoisier estava obcecado com a medição., Ele desenvolveu um aparelho elaborado para medir tudo. Ele queimaria fósforo, como mostrado na Figura 1, e observaria a formação de um produto Branco flácido. O fósforo (o reagente neste caso) não era solúvel em água, mas o produto era, então ele coletou o produto com muito cuidado, separando-o do fósforo não reagido por lavagem com água. Após a secagem, ele pôde medir a quantidade de fósforo queimado, a quantidade de oxigênio consumido (porque ele conhecia a densidade do gás oxigênio), e a quantidade de produto formado., Ele descobriu que a massa do produto era a soma das massas de reagentes consumidos, em cada experiência. Esta é a lei de conservação da massa (que, na verdade, alguns alquimistas e químicos anteriores também tinham usado). Ele também observou que o fósforo não tem sabor, mas o produto, que ele chamou de ácido fosfórico, é azedo. Ele sabia a partir desses experimentos que em muitos casos os elementos se combinam em apenas determinadas proporções, e também que o oxigênio pode combinar com enxofre, fósforo, etc em duas razões diferentes., He gave us the terminology we still use today: sulfuric acid is composed of sulfur and more oxygen, sulfurous acid is composed of sulfur and less oxygen. – UEO significa menos oxigénio; – ic significa mais oxigénio. Veja a página de nomenclatura para mais detalhes.
Lavoisier prestou muita atenção à precisão e precisão. Por exemplo, no experimento que acabamos de descrever, ele mediu o volume de gás no jarro da campainha, antes e depois da reação, mas observou que depois da reação, você deve esperar até que a temperatura volte ao que era quando você mediu originalmente., Se o gás estiver quente quando você medir o seu volume após a reação, ele terá se expandido, e sua densidade padrão não será aplicável. Isso introduziria um erro sistemático nas medições: cada vez que você realizar a experiência, você vai pensar que há mais sobras de gás do que realmente existe, e sua medição não será precisa. Se o resultado médio da sua experiência está próximo do valor correto, é preciso. No entanto, se sua experiência dá números muito diferentes de cada vez, mesmo se a média é correta e a experiência é precisa, ela não é precisa., Precisão é a diferença entre a reunião “por volta das 2 horas” e reunião “em 3 minutos e 27 segundos antes das 2 horas.”Precisão é o quão específico você é, quanto detalhe você usa. Lavoisier também ajudou a desenvolver o sistema de unidades (kg, L, m) que estão atualmente em uso na Coreia e em muitos outros países.

no Geral, enquanto ele não fez muitas experiências originais, que ninguém tinha feito antes, ele fez o seu trabalho e experimentos com muito cuidado, de modo que eles foram tão exata e precisa possível, e, em seguida, pensou-los claramente e criou palavras para descrever o de produtos químicos e ideias que ajudaram a tornar tudo mais claro., Se você ler um livro de química escrito antes de Lavoiser, você vai ficar muito confuso, porque os nomes de produtos químicos seriam baseados na história (e soaria como eles vieram de Harry Potter), em vez de ser baseado no que os produtos químicos são. Se você ler um texto de química escrito depois de Lavoiser, você vai reconhecer a linguagem como semelhante ao que usamos hoje.
resumo
exatidão descreve o quão próximo um valor medido está do valor real. A precisão descreve como um grupo de valores medidos está de acordo entre si., A lei de conservação das massas afirma que a matéria não pode ser criada nem destruída por um processo químico ou físico. Isto resulta na soma das massas de reagente consumidas em qualquer experiência é igual à massa do produto. As alterações químicas envolvem a alteração da identidade química de uma substância, de modo a que novas substâncias sejam formadas. As alterações físicas envolvem a alteração de uma substância sem alterar a sua identidade química. Combustão e enferrujamento são dois exemplos de processos químicos, enquanto ebulição e fusão são exemplos de processos físicos., Reações químicas envolvem transformar reagentes, produtos químicos que são consumidos no processo de mudança química, em produtos, produtos químicos produzidos através do processo de mudança química que têm uma composição diferente dos reagentes. Um reagente limitante determina, ou limita, a quantidade de produto que pode ser produzida a partir de uma reação química.
Fora do Link
- CrashCourse Química: A Lei Fundamental (11 min)
Colaboradores e Atribuições
-
Emily V Eames (Faculdade da Cidade de San Francisco)