Introduction
Policystic ovary syndrome (PCOS) is one of the most common disorders of endocrinology in women of reproductive age. É diagnosticado por meio da confirmação da presença de dois dos seguintes: oligo e/ou anovulação, hiperandrogenismo clínico e/ou bioquímico, e características de ultrassom de ovários policísticos, com exclusão de outras etiologias (Fr e Tarlatzis, 2004)., As taxas de prevalência dos OCP dependem dos critérios de diagnóstico utilizados, mas podem atingir 18% quando se utilizam os critérios de diagnóstico de Roterdão (Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group, 2004). O hiperandrogenismo é encontrado em 60-80% das mulheres com o soco (Azziz et al., 2006). As principais características clínicas ou bioquímicas do hiperandrogenismo são acne, hirsutismo, alopecia e dermatite seborréica; níveis elevados de testosterona, androstenediona e sulfato dehidroepiandrosterona; e níveis reduzidos de globulina ligante hormonal sexual (SHBG)., A síndrome não só apresenta manifestações reprodutivas, mas também tem implicações metabólicas, incluindo resistência à insulina, dislipidemia, obesidade, diabetes tipo 2, e inflamação sistémica (Deugarte et al., 2005; Sartor and Dickey, 2005; Escobar-Morreale et al., 2011).embora o tratamento de primeira linha para a indução da ovulação em mulheres com SOP seja a administração de citrato de clomifeno, pensa-se que os efeitos antiestrogénicos do citrato de clomifeno no endométrio e muco cervical causam uma baixa taxa de concepção de 20% (Gonen e Casper, 1990)., O citrato de clomifeno está também associado a vários efeitos secundários, incluindo afrontamentos, desconforto mamário, distensão abdominal, náuseas, vómitos, nervosismo, dores de cabeça, queda de cabelo e perturbações da visão (Legro et al., 2007a). Estudos recentes investigaram o papel da metformina como agente sensibilizante da insulina e, embora a sua utilização esteja a aumentar, a compreensão do seu mecanismo é incompleta (Legro et al., 2007b)., Além disso, pode causar o desenvolvimento de folículos múltiplos, juntamente com um risco de hiperestimulação ovárica, gravidezes múltiplas e malformações congénitas, tais como malformações do tubo neural, conduzindo assim a resultados potencialmente insatisfatórios no tratamento.
Uma vez que os SOP são definidos como uma perturbação metabólica-endócrina multifactorial (Laven et al., 2002), o estilo de vida e a dieta, em particular a Dieta Mediterrânica, desempenham um papel relevante, juntamente com o tratamento farmacológico (Barrea et al., 2019)., Estudos recentes têm sugerido que Tratamentos complementares e alternativos, incluindo medicamentos à base de plantas e acupuntura, podem aliviar os sintomas dos PCOS, mas a evidência de sua eficácia e segurança é insuficiente. Por isso, novas estratégias de tratamento que incorporem terapias complementares e alternativas precisam ser investigadas para otimizar o tratamento de SOP. Neste estudo, revimos dados sobre os efeitos e mecanismos subjacentes dos medicamentos à base de plantas utilizados no tratamento do modelo de SOP em estudos laboratoriais.,
Methods
Articles published in English up to June 30, 2018 were searched in Medline (via PubMed) and EMBASE (via Elsevier). Os Termos de busca foram uma combinação de tópicos médicos (MeSH) Termos e seus sinônimos. Os Termos de busca utilizados foram os seguintes: e .
os critérios de inclusão da nossa revisão incluíram o seguinte:
1. Estudos in vitro e in vivo que avaliaram os potenciais efeitos dos medicamentos à base de plantas no modelo dos PCOS
2., Research on the compounds isolated from herbs, individual herbal extracts, or herbal formula decoctions
3. Artigos escritos em inglês
Os critérios de exclusão foram os seguintes:
1. Ensaios clínicos de medicamentos à base de plantas para os medicamentos para uso humano
2. Revisão dos artigos
3., Artigos que não descreveram os Componentes da medicina herbal; no entanto, isso foi permitido no caso de medicamentos herbais patenteados
entre os estudos recuperados, após a remoção dos duplicados, os títulos e resumos foram revistos para encontrar artigos potencialmente relevantes. Em seguida, os textos completos de artigos selecionados foram revisados para confirmar que eles cumpriram nossos critérios de inclusão.,
extraímos dados relativos à intervenção à base de plantas; utilização de células-alvo( ou modelo animal); método de extracção à base de plantas: via de administração; dosagem e períodos; e resultados dos compostos isolados a partir de ervas, extractos à base de plantas individuais e decocções de fórmulas à base de plantas. Com base nesses dados, resumimos as ações e os mecanismos subjacentes aos efeitos benéficos dos medicamentos à base de plantas sobre o modelo PCOS.resultados
características do estudo
na presente revisão, incluímos um total de 27 estudos envolvendo 22 medicamentos à base de plantas que relataram a sua eficácia no modelo dos PCOS., Identificamos dois estudos in vitro, 22 estudos in vivo e três estudos com experimentos in vitro e in vivo. As intervenções herbais nos 27 estudos incluíram quatro compostos isolados de Ervas (6 estudos), nove extratos herbais individuais (11 estudos) e nove decocções de fórmulas herbais (10 estudos). Um diagrama de fluxo do processo de seleção do artigo é mostrado na Figura 1.
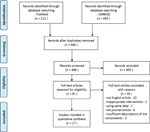
Figura 1 Diagrama de fluxo do processo de selecção do estudo.,
de Ervas Intervenções e Seus Resultados de Laboratório
Compostos Isolados De Ervas
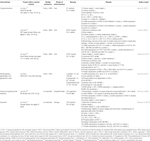
a Tabela 1, In vitro e in vivo, estudos de compostos isolados de ervas (n=6).
extractos vegetais individuais
Aloe vera (L.) Burm.F. redução dos níveis plasmáticos de colesterol total( CT), triglicéridos (TG) e colesterol das lipoproteínas de baixa densidade (C-LDL); aumento dos níveis de colesterol das lipoproteínas de alta densidade (C-HDL) (Desai et al.,, 2012); crescimento folicular normalizado; e recuperou o ciclo estroso (Maharjan et al., 2010). Atractylodes macrocephala Koidz. induced the recovery of the estrous cycle and the reduction of testosterona levels, androstenediona levels, the free androgen index, LH levels, the LH/FSH ratio, and anti-Müllerian hormone levels (Zhou et al., 2016). Ratos fêmea Wistar tratados com Matricaria chamomilla L. mostraram quistos diminuídos no tecido ovárico e um aumento do número de folículos dominantes (Zangeneh et al., 2010). Cocos nucifera L., recuperou o ciclo estroso; reduziu a CT, os níveis de colesterol de densidade muito baixa e de TG; e aumentou os níveis de C-HDL (Soumya et al., 2014). As fêmeas tratadas com Linum usitatissimum L. de ratos DP mostraram um aumento dos folículos antrais e dos corpos lúteos, uma diminuição do número de folículos císticos e uma redução do diâmetro dos folículos antrais (Jelodar e outros., 2018). Foeniculum vulgare Mill. induziu glomérulo normal, membrana basilar normal e capilares (Sadrefozalayi e Farokhi, 2014)., Zingiber officinale Roscoe baixou os níveis de LH e estrogénio e aumentou os níveis de FSH e progesterona em ratos DP fêmeas neonatais (Atashpour et al., 2017). Ginseng vermelho coreano (Panax ginseng C. A. Mey.)- ratos fêmeas tratados com SD mostraram menos folículos císticos e a expressão mRNA de NGF nos ovários (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata aumentou a taxa de perfusão de glucose e reduziu os níveis de TC e TG (Mannerås et al., 2010). Os dados estão resumidos no quadro 2.,
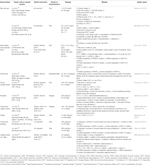
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., A medicina tradicional chinesa (CHM) 1 (Raiz Astragali Raiz Rehmanniae Preparata, Cuscuta me chinês Lam, Fruto Vidas Lucidi, Fruto Psoraleae, a Raiz de Salviae Miltiorrhizae, framboesa e Linn) e CHM 2 (Cuscuta me chinês Lam, Fruto Vidas Lucidi, framboesa e Linn) induzida pela recuperação do estrous cycle e o LH/FSH relação, e a redução da androstenediona deve níveis e livre de andrógeno índice (Gu et al., 2015)., Gui Zhu Yi Kun fórmula (GZYKF) (Semen Cuscutae, Rizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia, e Luffa cilíndrica) redução de mRNA de expressões de Beclin 1, cadeia leve 3 e supressor de tumor p53 (Xing et al., 2017). Os ratos fêmeas tratados com HemoHIM (Angelica Radix, Cnidii Rhizoma e Paeonia Radix) apresentaram um aumento do número e tamanho de corpos lúteos e uma diminuição do nível de proteína NGF nos ovários (Kim et al., 2009). Heqi san foi encontrado para reduzir os níveis de LH e testosterona ,e para mitigar a resistência à insulina (Zhao et al., 2017)., Um romance de ervas imunomodulador de drogas (IMOD) (Rosa canina, Urtica dioica, e Tanacetum vulgare)-tratados feminino ratos albinos da raça Wistar mostrou menor incidência de cancro do ovário atretic cística e pilosos, e um aumento do número de corpora lutea (Rezvanfar et al., 2012). A administração de Kyung-Ok-Ko (KOK) induziu a recuperação do ciclo estroso e do aglomerado de diferenciação (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, proteína quimioattractante monócito (MCP)-1 e redução da expressão de mRNA iNOS nos ovários de ratos SD femininos (Jang et al., 2014; Lee et al., 2016)., Feminino SD ratos tratados com Xiao-Yao-San (XYS) (radix bupleuri, a angélica, a radix paeoniae alba, rizoma atractylodis macrocephalae, poria, gengibre, hortelã, e glycyrrhizae) mostraram uma redução do número de folículos císticos e baixou terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) positivo células do folículo antral (Sun et al., 2017). Os dados estão resumidos no quadro 3.

Tabela 3 estudos in vitro e in vivo de decocções de fórmulas à base de plantas (n=10).,
As Acções de Medicamentos fitoterápicos para o Tratamento da SOP

a Tabela 4, As ações de medicamentos fitoterápicos para o tratamento da SOP.
Os Mecanismos de Ação para PCOS

a Tabela 5 Os mecanismos de ação dos medicamentos fitoterápicos em PCOS.,
discussão
a nossa revisão da literatura publicada até 30 de junho de 2018 resumiu os resultados de estudos in vitro e in vivo sobre a eficácia de medicamentos à base de plantas para o tratamento do modelo de PCOS. Um total de quatro compostos isolados de Ervas (6 estudos), nove extratos herbais individuais (11 estudos), e nove decocções de fórmula herbal (10 estudos) foram encontrados para ter efeitos inibitórios sobre os PCOS., De acordo com os resultados notificados, os medicamentos à base de plantas normalizaram as hormonas femininas, as hormonas masculinas diminuídas, recuperaram o ciclo estroso, melhoraram a resistência à insulina e melhoraram o metabolismo lipídico. Descobrimos que a actividade inibitória potencial dos medicamentos à base de plantas pode influenciar diferentes aspectos dos OPC, com os efeitos benéficos dos medicamentos à base de plantas que surgem principalmente através da anti-inflamação, stress anti-oxidativo, inibição da autofagia ou apoptose, e redução do NGF ovárico.,os medicamentos à base de plantas podem inibir as condições inflamatórias dos SOP
estudos recentes exploraram ainda mais a etiologia e a patologia dos SOP. Os cientistas descobriram que no microambiente de pacientes com SOP, a inflamação crônica leve é uma característica da síndrome (Nestler, 2000). Os SOP têm sido relevantes em inflamação crónica (Benson et al., 2008), e macrófagos têm sido sua maior patogênese (Wu et al., 2004). Os macrófagos ováricos produzem citoquinas, quimioquinas e factores de crescimento, tanto nos processos normais como nos processos inflamatórios do ovário., Os macrófagos podem orquestrar apoptose e remodelação dos tecidos, que estão envolvidos na foliculogénese, ovulação e formação do corpo lúteo (Benson et al., 2008). Dado o papel crítico dos macrófagos nos PCOS (Benson et al., 2008), numerosos estudos compararam os níveis séricos de citoquina e os fluidos foliculares em doentes com SOP. Os níveis séricos de TNF-α e IL-6 e nos fluidos foliculares foram elevados em doentes com socos não obesos/não diabéticos tratados com gonadotrofinas (Amato et al., 2003)., A proteína inflamatória macrófaga-1α e MCP-1 foram aumentadas em doentes com SOP e associadas à adiposidade (Glintborg et al., 2009). iNOS, ciclooxigenase-2 (COX-2) e actividade transformadora do factor de crescimento (TGF)-β aumentaram nos ovários dos doentes com SOP (Elia et al., 2006; Hatzirodos et al. A administração de metformina impediu a actividade iNOS e COX-2 (Elia et al., 2006). Estes resultados sugerem que o sistema imunológico é relevante para a patogênese dos PCOS., Portanto, novos remédios que visam este processo inflamatório pode ser uma alternativa terapêutica ao tratamento atual.
nesta revisão, os iridóides inibiram significativamente a expressão IL-1β, IL-6, IL-10 e iNOS, inibindo assim as condições inflamatórias (Zuo et al., 2017). Quercetin também reduziu significativamente os níveis de IL-1β, IL-6, e TNF-α, e diminuiu a translocação nuclear do fator nuclear kappa B (NF-kB) em um modelo de rato PCOS resistente à insulina (Wang et al., 2017)., A pré-administração de KOK diminuiu a expressão aumentada da molécula de adaptador ionizado de ligação ao cálcio-1 ( + ) macrófagos na camada celular de cistos e no estroma. KOK também aumentou a expressão de mRNA do CD11b e CD3 no tecido ovárico dos PCOS. A pré-administração de KOK diminuiu significativamente os níveis aumentados de IL-1β, IL-6, IL-8, TNF-α, MCP-1 e iNOS; e aumentou a redução da expressão mRNA do factor de crescimento epidérmico e TGF-β nos ovários de PCOS., Estes resultados demonstraram que KOK regula a expressão de mediadores inflamatórios no modelo dehidroepiandrosterona (DHEA) induzido por PCOS (Jang et al., 2014). Mediadores inflamatórios também foram regulados no endométrio do útero pela administração de KOK, que tem sido mostrado para prevenir hiperplasia endometrial em modelos de OCP (Lee et al., 2016). Foi também demonstrado que o TNF-α no soro e a prostaglandina e (PGE) no ovário foram diminuídos por IMODs (Rezvanfar et al., 2012).,
Ervas medicinais Pode Atenuar o Estresse Oxidativo em PCOS
espécies Reativas de oxigênio são importantes moléculas sinalizadoras na regulação das funções fisiológicas no feminino reprodução, incluindo esteroidogénese, a foliculogénese, a maturação de oócitos, corpo lúteo, função, e luteolysis (Agarwal et al., 2005). Além disso, desempenham um papel fundamental nos processos patológicos de reprodução feminina (Agarwal et al., 2003; Agarwal et al., 2008)., O stress oxidativo é uma condição na qual o equilíbrio entre a capacidade antioxidante do corpo e os produtos tóxicos derivados de oxigénio e/ou azoto é prejudicado. Consequentemente, os radicais livres não são suficientemente desintoxicados pelos antioxidantes celulares. O stress oxidativo desempenha um papel importante na reprodução feminina (Ruder et al., 2008; Ruder et al., 2009; Vakilian et al., 2009), e há uma literatura crescente sobre os efeitos do aumento dos marcadores de estresse oxidativo em fêmeas inférteis, e sobre o seu envolvimento na fisiopatologia dos OCP (Joo et al., 2010; Mohamadin et al., 2010)., Os PCOS são caracterizados por inflamação crônica, estresse oxidativo e expressão anormal da microRNA (Zhao et al., 2015; Zuo et al., 2016). Como se sabe que a inflamação e o estresse oxidativo estão intimamente ligados, o estresse oxidativo elevado geralmente resulta de, e leva a, uma condição inflamatória (Zuo et al., 2016). É difícil separar a inflamação do estresse oxidativo, e tem sido proposto nos últimos anos que a inflamação e o estresse oxidativo compõem a principal base da ocorrência da doença (Duleba e Dokras, 2012).
nesta revisão, IMODs (Rezvanfar et al.,, 2012) e iridoids (Zuo et al., 2017) mostrou efeitos positivos sobre o estresse oxidativo/nitrosativo, direta ou indiretamente, principalmente através da redução dos radicais livres e inibindo citocinas inflamatórias em ratos de PCOS. A administração de IMODs reduziu significativamente a peroxidação lipídica (um marcador de stress oxidativo) e aumentou os níveis de superóxido dismutase, catalase e glutationa peroxidase (marcadores de potencial antioxidante) nos PCP induzidos pelo hiperandrogenismo. Além disso, os níveis de peroxinitrite (um marcador de estresse nitrosativo), TNF-α e PGE foram significativamente reduzidos por IMODs., Além disso, estes efeitos dos IMODs foram consistentes com a evidência histológica, que mostrou melhoria significativa nas características microscópicas da foliculogénese em comparação com as do grupo de controlo (Rezvanfar et al., 2012). O sistema de sinalização NF-kB é conhecido como um paradigma dominante para moléculas de transdução de sinais específicos, ativação de genes e proteínas reguladoras em resposta à inflamação (Ivanenkov et al., 2011)., Os iridóides atenuaram eficientemente a elevação induzida pelo lipopolissacárido dos níveis de fosforilação IkB, diminuíram os níveis de expressão IkB e diminuíram os NF-kB P65, indicando que os iridóides exercem os seus efeitos antioxidantes através da via NF-kB (Zuo et al., 2017).os medicamentos à base de plantas podem regular a apoptose e/ou a autofagia em PORP
a sobrevivência ou morte das células granulosas é reconhecida como um factor crítico que afecta o destino dos folículos (Matsuda et al., 2012). Apoptose e autofagia são duas formas de morte celular programada., Autofagia é o processo pelo qual um autofagossomo, que é uma vesícula de membrana dupla, transporta material citoplasmático para o lisossomo (Mizushima e Komatsu, 2011). Foi relatado que tanto a apoptose como a autofagia podem ser induzidas nas células da granulosa, e que estão envolvidas no controlo do desenvolvimento folicular (Choi et al., 2010; Choi et al., 2013). As células granulosas são reconhecidas como intervenientes críticos no desenvolvimento folicular. Produzem estradiol, factores de crescimento tipo insulina e outras citoquinas no ovário e expressam os receptores do estradiol, LH e FSH (Juengel et al.,, 2006), todos os quais participam na regulação do desenvolvimento folicular. Assim, qualquer diminuição das células da granulosa pode resultar no desenvolvimento desordenado dos folículos.na última década, foram identificadas vias de sinalização relacionadas com a autofagia e os seus principais reguladores proteicos. A proteína 1 cadeia de luz 3 associada ao microtúbulo de rato está associada ao processamento da membrana autofagossómica (Kabeya et al., 2000). Beclin-1 também demonstrou ter um papel crítico na formação de autofagossomas (Von Hoven et al., 2012)., Além disso, estudos anteriores identificaram o supressor do tumor p53 (p53) como um modulador duplo de autofagia na regulação da morte ou sobrevivência celular (Vousden e Ryan, 2009; Zhang et al., 2010). Com baixos níveis de energia, a proteína cinase activada pela adenosina monofosfato (AMPK), que é activada pela p53, é capaz de activar o complexo de esclerose tuberosa 2, inibindo assim o alvo mamífero da actividade da rapamicina (mTOR) e aumentando a autofagia (Feng et al., 2007)., Nesta revisão, a p53, que é activada pelo GZYKF no núcleo, por sua vez activou o AMPK e o sestrin, actuando como um feedback da inibição do mTOR, activando assim a autofagia. A autofagia é também modulada por vias sinalizadoras fosfoinositida 3-cinase/proteína cinase B (PI3K/Akt) (Pyo et al., 2012). Nesta revisão, XYS atenuado a redução da fosforilação da proteína ribossomal S6 quinase polipeptídeo eu e Akt, bem como o aumento de microtubule-proteína associada cadeia leve 3-I microtubule-proteína associada cadeia leve 3-II a conversão tanto in vivo e in vitro (Sun et al., 2017).,
a endometria da maioria dos doentes com SOP é espessa e apresenta hiperplasia simples, complicada ou atípica ou transformação maligna que pode estar correlacionada com a apoptose das células endométricas (Villavicencio et al., 2007). O hiperandrogenismo induzido pela DHEA está associado a um maior número de células apoptóticas na endometria e a metformina (um agente insulinomimético ou sensibilizante da insulina) é capaz de reduzir o número aumentado de células apoptóticas (Elia et ai., 2009). Nesta revisão, a morte de células apoptóticas foi avaliada por coloração de TUNEL., As células apoptóticas raramente foram detectadas por coloração de TUNEL no tecido uterino do sham ou do grupo KOK-alone. No entanto, o número de células TUNEL-positivas aumentou na endometria do grupo DHEA. O aumento do número de células apoptóticas foi significativamente reduzido após a administração de KOK. Estes resultados indicam que a pré-administração de KOK inibiu a malformação endometrial induzida pelo DHEA através da redução da apoptose endometrial (Lee et al., 2016).,
os Medicamentos fitoterápicos Podem Reduzir o Nível de NGF em PCOS
estudos Anteriores têm mostrado que a SOP é associada com a ativação anormal do sistema nervoso simpático, resultando em aumento de catecholaminergic nervos (Semenova, 1969), perturbações do metabolismo da norepinefrina (Garcia-Rudaz et al., 1998), e aumento da atividade dos nervos simpatizantes via nervo ovárico superior (Lara et al., 1993)., O desenvolvimento e a função da inervação simpática ovárica dependem do ovário para a produção de NGF, uma neurotrofina derivada do alvo necessária para o desenvolvimento do sistema simpático periférico (Levi-Montalcini, 1987). A família neurotrofina, implica o receptor NGF e NGF mRNA na ovulação e na patofisiologia dos PCOS (Lara et al., 2000; Stener-Victorin et al., 2003). Nos ovários de rato, o NGF é sintetizado principalmente nas células da parede folicular (Dissen et al.,, 1996), e em PCOS, a ativação do NGF pode ser um fator envolvido no aumento do fluxo de norepinefrina para a glândula, o que é induzido pelo valerato de estradiol (EV) (Lara et al., 2000) PCOS exibe uma alta densidade de fibras nervosas intraovarianas que é associada com a hiperreactividade simpática (Stener-Victorin et al., 2003).
nesta revisão, a administração de fórmulas de ervas Changbudodam-Tang e Yongdamsagan-Tang diminuiu significativamente elevados NGF nos ovários, com pouco efeito no tecido cerebral (Lee et al., 2003)., HemoHIM também normalizou o NGF, baixou o elevado número de folículos antrais, e aumentou o número de corpos lutea em PCOS. Estes resultados são consistentes com os de estudos anteriores sobre os efeitos benéficos de HemoHIM na prevenção e tratamento de PCOS (Pak et al., 2009). Além disso, a administração do extrato de ginseng vermelho coreano (Pak et al., 2009; Jung et al., 2011) and Korean red ginseng total saponins (Pak et al., 2005) diminuiu significativamente a expressão de proteínas NGF e ARNm NGF, em comparação com as dos ovários tratados com EV.,este estudo analisou a evidência de medicamentos à base de plantas que podem ser utilizados no tratamento dos OCP e dos seus sintomas associados, e os resultados destinam-se a aumentar a compreensão dos clínicos sobre os mecanismos de acção dos medicamentos à base de plantas no tratamento dos OCP. A principal limitação do nosso estudo é a heterogeneidade das intervenções. Além disso, nosso estudo não realizou uma avaliação de qualidade de cada estudo ou uma síntese quantitativa dos resultados. São necessários outros estudos que incluam a avaliação da qualidade metodológica e a síntese quantitativa dos resultados.,
conclusão
nesta revisão, um total de 27 estudos envolvendo 22 medicamentos à base de plantas exibiram efeitos benéficos sobre os OCP. As intervenções herbais nos 27 estudos incluíram quatro compostos isolados de Ervas (6 estudos), nove extratos herbais individuais (11 estudos) e nove decocções de fórmulas herbais (10 estudos). Os medicamentos à base de plantas foram mostrados para normalizar hormônios femininos, diminuir hormônios masculinos, recuperar o ciclo estroso, melhorar a resistência à insulina, e melhorar o metabolismo lipídico em PCP., Os mecanismos subjacentes aos efeitos benéficos dos medicamentos à base de plantas sobre os OPC estão associados a anti-inflamação, stress anti-oxidativo, inibição da autofagia e/ou apoptose e redução do NGF ovárico. Os medicamentos à base de plantas podem ser considerados como recursos promissores no desenvolvimento de agentes terapêuticos eficazes para os SOP.
contribuições dos autores
i-HC e KP desenharam o estudo. C-YK e KP pesquisaram os artigos e analisaram os dados. A KP escreveu o manuscrito e a I-HC reviu-o. Todos os autores contribuíram para o artigo e aprovaram a versão submetida.,
financiamento
Este trabalho foi apoiado pela National Research Foundation of Korea (NRF) grant financiado pelo Governo da Coreia (MSIP) (No.NRF-2017R1C1B1006387) e a sociedade coreana de Ginseng (2019).
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE / ASRM-Sponsored PCOS Consensus Workshop Group (2004). Consenso revisto de 2003 sobre critérios diagnósticos e riscos a longo prazo para a saúde relacionados com a síndrome do ovário policístico. Fertilidade Esterilidade 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Full Text/Google Scholar
Semenova, I. (1969). Inervação adrenérgica de ovários na síndrome de Stein-Leventhal. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar