Um catalisador é uma substância que acelera uma reação química, mas não é consumida pela reação; portanto, um catalisador pode ser recuperado quimicamente inalterado ao final da reação foi utilizado para acelerar, ou catalisar.

para os produtos químicos reagirem, as suas ligações devem ser rearranjadas, porque as ligações nos produtos são diferentes das dos reagentes.,O passo mais lento no rearranjo de ligação produz o que é chamado de Estado de transição – uma espécie química que não é nem um reagente nem um produto, mas é um intermediário entre os dois.
Energy is required to form the transition state. Esta energia é chamada de energia de ativação, ou Ea.A leitura do diagrama abaixo da esquerda para a direita mostra o progresso de uma reação quando os reagentes passam pelo Estado de transição para se tornarem produtos.,
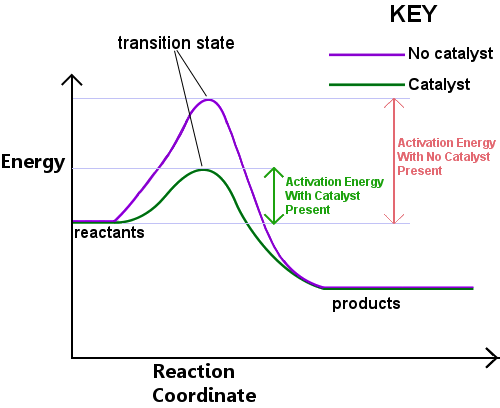
a energia de ativação pode ser considerada como uma barreira a uma reação química, um obstáculo que deve ser cruzado.Se a barreira é alta, poucas moléculas têm energia cinética suficiente para colidir, formar um estado de transição e atravessar a barreira.Reagentes com energia inferior à Ea não podem passar pelo Estado de transição para reagir e se tornar produtos.
um catalisador funciona fornecendo uma rota diferente, com Ea inferior, para a reação. Catalisadores baixam a barreira de energia.,A rota diferente permite que os rearranjos de ligação necessários para converter reagentes para produtos a ter lugar mais facilmente, com uma energia mais baixa input.In em qualquer intervalo de tempo dado, a presença de um catalisador permite que uma maior proporção da espécie reagente pegue energia suficiente para passar pelo Estado de transição e se tornar produtos.
exemplo 1: o processo Haber
O processo Haber, que é usado para fazer amônia a partir de hidrogênio e nitrogênio, é catalizado pelo ferro, que fornece locais atômicos nos quais as ligações reagentes podem rearranjar mais facilmente para formar o estado de transição.,
Exemplo 2: Enzimas
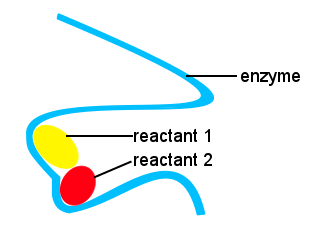
Em nossos corpos, e em outras coisas vivas, enzimas são utilizadas para acelerar as reações bioquímicas. Uma enzima é um tipo de catalisador.A vida complexa seria impossível sem enzimas para permitir que as reações ocorressem a velocidades adequadas.As formas das enzimas, juntamente com os locais na enzima que se ligam aos reagentes, fornecem uma via de reação alternativa, permitindo que moléculas específicas se unam para formar um estado de transição com uma barreira energética de ativação reduzida.,
no esquema abaixo, a enzima de cadeia longa fornece locais para moléculas reagentes se unirem para formar um estado de transição com uma energia de ativação baixa.
catalisadores não podem mudar a posição de um equilíbrio químico – as reações para a frente e para trás são aceleradas de modo que a constante de equilíbrio Keq é inalterada.No entanto, ao retirar os produtos da mistura de reacção tal como se formam, a taxa global de formação do produto pode, na prática, ser aumentada.