vaardigheden om
- begrijpen waarom Lavoisier soms wordt genoemd “de vader van de moderne chemie”
- onderscheid nauwkeurigheid van precisie
dus wat gebeurde er met het veranderen van alchemie, die was als magische potion-brouwen in Harry Potter, in de wetenschap van chemie? Het was meting. Zorgvuldige, zorgvuldige meting van hoeveelheden, zoals massa ‘ s, volumes, dichtheden, temperaturen, drukken.
Een vroege held van de meting was Antoine Lavoisier., Hij was een van de eerste echte chemische wetenschappers. Hij voerde zorgvuldige experimenten uit, en probeerde GEEN conclusies te trekken, behalve die vereist door zijn gegevens. Hij zei dat feit, idee en woord zo nauw mogelijk met elkaar verbonden moeten zijn: dat je je taal niet kunt verbeteren zonder je denken te verbeteren, en je kunt je denken niet verbeteren zonder je taal te verbeteren. Hij was de pionier van een systematische chemische nomenclatuur die we vandaag gebruiken., Opmerkelijk, als je leest zijn tekst, geschreven in 1789, bedoeld om chemie te introduceren aan beginners, veel van het is nog steeds perfect begrijpelijk en zelfs correct door moderne normen.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier beschrijft eerst de toestanden van materie: gassen, vloeistoffen en vaste stoffen. Hij wijst erop dat wanneer een vast materiaal wordt verwarmd, het de neiging heeft uit te breiden, wordt eerst een vloeistof, die een constant volume inneemt, maar kan worden gegoten, in tegenstelling tot een vaste stof., Meer verwarming, en het wordt een gas, die hij beschrijft als elastisch omdat het zal uitzetten of comprimeren tot verschillende volumes, afhankelijk van de druk. In tegenstelling tot de Griekse filosofen, begreep hij dat dit een fysieke verandering is, geen chemische verandering, en hij heeft een goede submicroscopische intuïtie van wat er gebeurt: de deeltjes van het materiaal veranderen niet, ze komen gewoon verder uit elkaar.,
hij verbrandde zwavel en fosfor en houtskool (koolstof) en maakte zorgvuldige observaties, vaak met behulp van de klokkenpot over een emmer kwik zoals te zien is in de tekening uit zijn boek, figuur 1. Dit is een voorbeeld van een chemische verandering of chemische reactie, waarbij reactieve chemicaliën veranderen in verschillende productchemicaliën. Als je de zwavel in de schaal met het label D onder de klokpot van lucht aansteekt, brandt het tot het uit gaat en laat wat extra zwavel achter. De resterende lucht in de pot is niet langer goed voor de ademhaling. Als je een muis in de pot stopt, zal hij sterven, net als de vlam., Dit demonstreert het concept van het beperken van reactant. De reactie of het branden stopte toen het geen zuurstof meer had, waardoor voornamelijk stikstof (en een paar sporen andere gassen) in de pot achterbleven. Priestley, een andere wetenschapper, toonde hem hoe hij zuiver zuurstofgas moest bereiden, en hij gebruikte dit ook om vele brandexperimenten te doen.
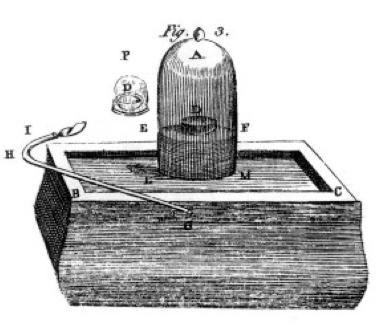
Lavoisier was geobsedeerd door metingen., Hij ontwikkelde uitgebreide apparatuur voor het meten van alles. Hij zou fosfor verbranden, zoals weergegeven in Figuur 1, en de vorming van een wit schilferig product observeren. De fosfor (de reagens in dit geval) was niet oplosbaar in water, maar het product wel, dus verzamelde hij het product zeer zorgvuldig en scheidde het van de niet-gereageerde fosfor door het wassen met water. Na het drogen kon hij meten hoeveel fosfor was verbrand, hoeveel zuurstof was verbruikt (omdat hij de dichtheid van zuurstofgas kende) en hoeveel product was gevormd., Hij ontdekte dat de massa van het product de som was van de massa van de verbruikte reagentia, in elk experiment. Dit is de wet van het behoud van massa (die, eigenlijk, sommige vroegere alchemisten en chemici ook hadden gebruikt). Hij merkte ook op dat het fosfor geen smaak heeft, maar dat het product, dat hij fosforzuur noemde, zuur is. Hij wist uit deze experimenten dat in veel gevallen elementen slechts in bepaalde verhoudingen combineren, en ook dat zuurstof kan combineren met zwavel, fosfor, etc in twee verschillende verhoudingen., Hij gaf ons de terminologie die we nog steeds gebruiken: zwavelzuur is samengesteld uit zwavel en meer zuurstof, zwavelzuur is samengesteld uit zwavel en minder zuurstof. – ous betekent minder zuurstof; – ic betekent meer zuurstof. Zie de nomenclatuur pagina voor details.
Lavoisier besteedde veel aandacht aan nauwkeurigheid en precisie. Bijvoorbeeld, in het experiment dat we net beschreven, hij gemeten het volume van het gas in de klokkenpot, voor en na de reactie, maar merkte op dat na de reactie, Je moet wachten tot de temperatuur is teruggekeerd naar wat het was toen je oorspronkelijk gemeten., Als het gas heet is wanneer u het volume na de reactie meet, is het uitgebreid en is uw standaarddichtheid niet van toepassing. Dit zou een systematische fout in de metingen introduceren: elke keer dat u het experiment uitvoert, zult u denken dat er meer gas overblijft dan er eigenlijk is, en uw meting zal niet nauwkeurig zijn. Als het gemiddelde resultaat van uw experiment in de buurt van de juiste waarde is, is het accuraat. Echter, als uw experiment geeft zeer verschillende nummers elke keer, zelfs als het gemiddelde correct is en het experiment nauwkeurig is, het is niet precies., Precisie is het verschil tussen vergadering “rond 2 uur” en vergadering “op 3 minuten en 27 seconden voor 14 uur.”Precisie is hoe specifiek je bent, hoeveel detail Je gebruikt. Lavoisier heeft ook bijgedragen aan de ontwikkeling van het systeem van eenheden (kg, L, m) die momenteel in gebruik zijn in Korea en vele andere landen.

over het algemeen, hoewel hij niet veel originele experimenten deed die niemand anders eerder had gedaan, deed hij zijn experimenten zeer zorgvuldig, zodat ze zo nauwkeurig en nauwkeurig mogelijk waren, en toen dacht hij er duidelijk over na en creëerde woorden om de chemicaliën en ideeën te beschrijven die hielpen om alles duidelijker te maken., Als je een scheikundeboek leest dat Voor Lavoiser is geschreven, zul je erg in de war zijn omdat de namen voor chemicaliën gebaseerd zouden zijn op de geschiedenis (en zouden klinken alsof ze van Harry Potter kwamen), in plaats van Gebaseerd te zijn op wat de chemicaliën zijn. Als je een scheikundetekst leest die geschreven is na Lavoiser, zul je de taal herkennen als vergelijkbaar met wat we vandaag de dag gebruiken.
samenvatting
nauwkeurigheid beschrijft hoe dicht een gemeten waarde bij de werkelijke waarde ligt. Precisie beschrijft hoe goed een groep gemeten waarden met elkaar overeenkomen., De wet van behoud van massa stelt dat materie niet kan worden gecreëerd of vernietigd door een chemisch of fysisch proces. Dit resulteert in de som van de massa ‘ s reactant verbruikt in een experiment is gelijk aan de massa van het product. Chemische veranderingen houden in dat de chemische identiteit van een stof zodanig wordt veranderd dat nieuwe stoffen worden gevormd. Fysieke veranderingen houden in dat een stof wordt veranderd zonder de chemische identiteit te veranderen. Verbranding en roesten zijn twee voorbeelden van chemische processen, terwijl koken en smelten voorbeelden zijn van fysische processen., Chemische reacties omvatten het omzetten van reagentia, chemicaliën die worden verbruikt in het proces van chemische verandering, in producten, chemicaliën geproduceerd door het proces van chemische verandering die een andere samenstelling hebben dan de reagentia. Een beperkende reactant bepaalt, of beperkt, de hoeveelheid product die uit een chemische reactie kan worden geproduceerd.
Buiten Link
- CrashCourse Chemistry: the Fundamental Law (11 min)
bijdragers en Attributies
-
Emily V Eames (City College Of San Francisco)