thermodynamica is een tak van de fysica die zich bezighoudt met de energie en het werk van een systeem.Thermodynamica heeft alleen betrekking op de grootschalige respons van een systeem dat we in experimenten kunnen waarnemen en meten. Kleinschalige gasinteracties worden beschreven door de kinetische theorie van gassen.Er zijn drie principallaws van thermodynamica die op afzonderlijke dia ‘ s worden beschreven., Elke wet leidt tot de definitievan deermodynamische eigenschappen die ons helpen de werking van een fysisch systeem te begrijpen en te voorspellen. We zullen enkele eenvoudige voorbeelden van deze wetten en eigenschappen voor een verscheidenheid van fysische systemen presenteren, hoewel we het meest geïnteresseerd zijn in de thermodynamica van aandrijfsystemen en hoge snelheidsstromen.Gelukkig hebben veel van de klassieke voorbeelden van thermodynamica betrekking op gasdynamica.,
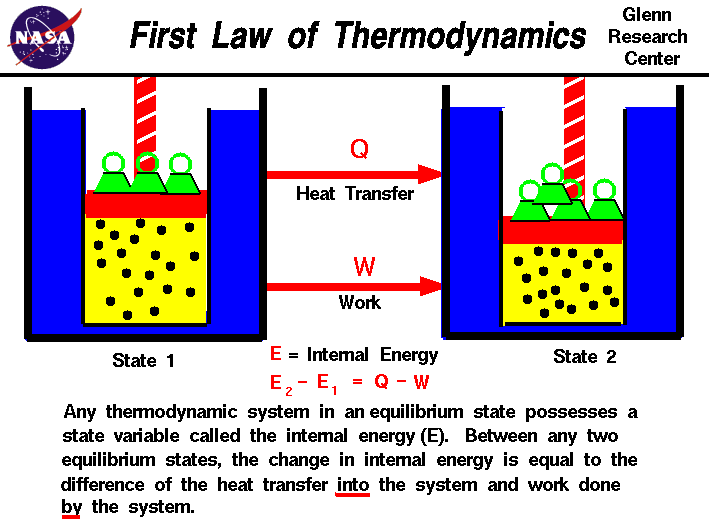
in onze waarnemingen van het werk dat op of door een gas wordt verricht,hebben we vastgesteld dat de hoeveelheid werk niet alleen afhangt van de begin-en eindtoestanden van het gas, maar ook van het proces of pad dat de eindtoestand produceert.Ook de hoeveelheid warmte die in of uit een gas wordt overgebracht, hangt af van de begin-en eindtoestand en het proces dat de eindtoestand produceert., Veel waarnemingen van reële gassen hebben aangetoond dat het verschil in de warmtestroom in het gas en het door het gas verrichte werk alleen afhankelijk is van de begin-en eindtoestand van het gas en niet afhankelijk is van het proces of de weg die de eindtoestand produceert. Dit suggereert het bestaan van een additionele variabele, genaamd de interne energie van het gas,die alleen afhankelijk is van de toestand van het gas en niet van een proces.De interne energie is een toestandsvariabele, net als de temperatuur of de druk., De eerste wet van de thermodynamica definieert de interne energie (E) als gelijk aan het verschil van de warmteoverdracht (Q) naar het systeem en het werk (W) dat door het systeem wordt gedaan.
E2 – E1 = Q – W
we hebben de woorden” into “en” by ” in de definitie benadrukt. Warmte die uit een systeem wordt verwijderd, zou in de vergelijking een negatief teken worden toegekend. Ook workdone op het systeem is een negatief teken toegewezen.,
de interne energie is gewoon een vorm van energie zoals de potentialenergie van een object op een bepaalde hoogte boven de aarde, of de kineticenergie van een object in beweging. Op dezelfde manier dat potentiële energie kan worden omgezet in kinetische energie terwijl de totale energie van het systeem wordt behouden, kan de interne energie van een thermodynamisch systeem worden omgezet in kinetische of potentiële energie. Net als potentiaalenergie kan de interne energie in het systeem worden opgeslagen.Merk echter op dat warmte en werk niet onafhankelijk kunnen worden opgeslagen of geconserveerd, omdat ze afhankelijk zijn van het proces., De eerste wet van de thermodynamica staat toe dat vele mogelijke toestanden van een systeem bestaan, maar alleen bepaalde toestanden worden gevonden om te bestaan in de natuur. De tweede wet van de thermodynamica helpt dit te verklaren.
als een systeem volledig geïsoleerd is van de buitenwereld, is het mogelijk een statusverandering te hebben waarbij geen warmte in het systeem wordt overgebracht. Wetenschappers verwijzen naar een proces dat geen heattransfer als adiabatisch proces impliceert.,De toepassing van de eerste wet van de thermodynamica voor gassen introduceert een andere nuttige toestandsvariabele genaamd de enthalpiedie op een aparte pagina wordt beschreven.
activiteiten:
rondleidingen
-
 thermodynamica:
thermodynamica: 
navigatie ..
![]()
![]()
![]()
startpagina