een katalysator is een stof die een chemische reactie versnelt, maar niet door de reactie wordt verbruikt; daarom kan een katalysator chemisch ongewijzigd worden teruggewonnen aan het einde van de reactie die hij heeft gebruikt om de reactie te versnellen of te katalyseren.

discussie
om te reageren moeten de bindingen van chemische stoffen worden herschikt, omdat de bindingen in de producten verschillen van die in de reagentia.,De traagste stap in de herschikking van de band produceert wat een overgangstoestand wordt genoemd-een chemische soort die noch een reactant noch een product is, maar een tussenproduct is tussen de twee.
energie is nodig om de overgangstoestand te vormen. Deze energie wordt de activeringsenergie of EA genoemd.Het lezen van het diagram hieronder van links naar rechts toont de voortgang van een reactie als reactanten door de overgangstoestand gaan om producten te worden.,
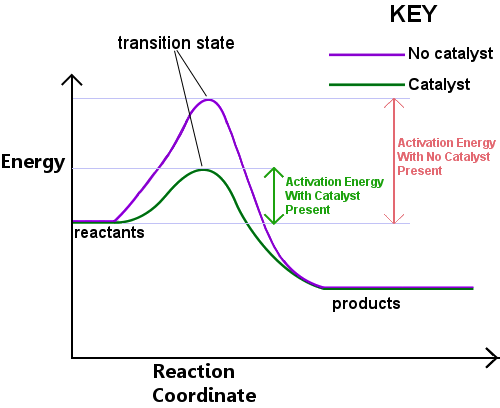
de activeringsenergie kan worden beschouwd als een barrière voor een chemische reactie, een hindernis die moet worden overschreden.Als de barrière hoog is, hebben weinig molecules voldoende kinetische energie om te botsen, een overgangstoestand te vormen, en de barrière te kruisen.Reactanten met een energie lager dan Ea kunnen niet door de transitietoestand heen om te reageren en producten te worden.
een katalysator werkt door een andere route, met lagere Ea, voor de reactie. Katalysatoren verlagen de energiebarrière.,De verschillende route zorgt ervoor dat de bond herschikkingen die nodig zijn om reagentia om te zetten in producten gemakkelijker kunnen plaatsvinden, met een lagere energie input.In om het even welk gegeven tijdsinterval, staat de aanwezigheid van een katalysator een groter deel van de reactantspecies toe om voldoende energie op te nemen om door de overgangstoestand te gaan en producten te worden.
Voorbeeld 1: het Haber-proces
Het Haber-proces, dat wordt gebruikt om ammoniak te maken uit waterstof en stikstof, wordt gekatalyseerd door ijzer, dat atomaire locaties biedt waarop de reactantbindingen gemakkelijker kunnen herschikken om de overgangstoestand te vormen.,
Voorbeeld 2: enzymen
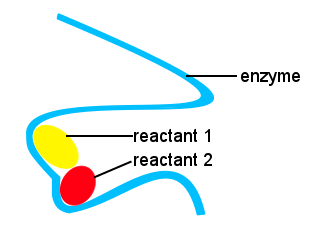
in ons lichaam en in andere levende wezens worden enzymen gebruikt om biochemische reacties te versnellen. Een enzym is een soort katalysator.Het complexe leven zou onmogelijk zijn zonder enzymen om reacties te laten plaatsvinden bij geschikte snelheden.De vormen van enzymen samen met plaatsen op het enzym die aan de reactanten binden verstrekken een alternatieve reactieweg, toestaand specifieke molecules om samen te komen om een overgangsstaat met een verminderde barriã re van de activeringsenergie te vormen.,
in het onderstaande schema biedt het lange kettingenzym plaatsen voor reactantmoleculen om samen te komen om een overgangstoestand met een lage activeringsenergie te vormen.
katalysatoren kunnen de positie van een chemisch evenwicht niet verschuiven – de voorwaartse en achterwaartse reacties worden beide versneld zodat de evenwichtsconstante Keq onveranderd blijft.Echter, door het verwijderen van producten uit het reactiemengsel als ze zich vormen, kan de totale snelheid van productvorming in de praktijk worden verhoogd.