sviluppo
- Capire perché Lavoisier è talvolta chiamato il “Padre della Chimica Moderna”
- Distinguere precisione di precisione
allora cosa è successo a girare alchimia, che era la pozione magica birra in Harry Potter, nella scienza della chimica? Era una misura. Attenta, attenta misurazione di quantità, quali masse, volumi, densità, temperature, pressioni.
Uno dei primi eroi della misurazione fu Antoine Lavoisier., Fu uno dei primi veri scienziati chimici. Ha condotto esperimenti accurati e ha cercato di trarre conclusioni tranne quelle richieste dai suoi dati. Ha detto che il fatto, l’idea e la parola dovrebbero essere il più strettamente connessi possibile: che non puoi migliorare la tua lingua senza migliorare il tuo pensiero, e non puoi migliorare il tuo pensiero senza migliorare la tua lingua. Così ha aperto la strada a una nomenclatura chimica sistematica che è essenzialmente ciò che usiamo oggi., Sorprendentemente, se leggi il suo testo, scritto nel 1789, destinato a introdurre la chimica ai principianti, gran parte di esso è ancora perfettamente comprensibile e persino corretto per gli standard moderni.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier prima descrive gli stati della materia: gas, liquidi e solidi. Sottolinea quando un materiale solido viene riscaldato, tende ad espandersi, diventando prima un liquido, che occupa un volume costante, ma può essere versato, a differenza di un solido., Più riscaldamento, e diventa un gas, che egli descrive come elastico perché si espanderà o comprimere a volumi diversi a seconda della pressione. A differenza dei filosofi greci, ha capito che questo è un cambiamento fisico, non un cambiamento chimico, e ha una buona intuizione su scala submicroscopica di ciò che sta accadendo: le particelle del materiale non cambiano, si allontanano.,
Bruciò zolfo, fosforo e carbone (carbonio) e fece osservazioni attente, spesso usando la campana sopra un secchio di mercurio come mostrato nel disegno dal suo libro, Figura 1. Questo è un esempio di cambiamento chimico o reazione chimica, in cui i reagenti chimici si trasformano in diversi prodotti chimici. Se si accende lo zolfo nel piatto etichettato D sotto la campana d’aria, brucia fino a quando non si spegne lasciando un po ‘ di zolfo in più. L’aria che rimane nel barattolo non è più buona per respirare. Se metti un topo nel barattolo, morirà, proprio come ha fatto la fiamma., Questo dimostra il concetto di limitare reagente. La reazione o la combustione si fermarono quando finì l’ossigeno, lasciando principalmente azoto (e qualche traccia di altri gas) nel barattolo. Priestley, un altro scienziato, gli mostrò come preparare il gas puro di ossigeno, e lo usò anche per fare molti esperimenti di combustione.
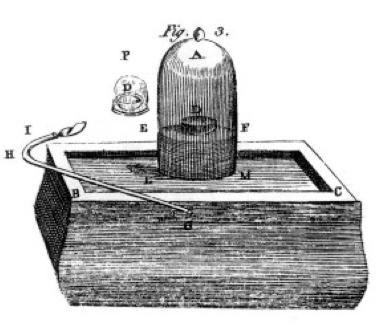
Lavoisier era ossessionato dalla misurazione., Ha sviluppato apparecchi elaborati per misurare tutto. Bruciava il fosforo, come mostrato nella Figura 1, e osservava la formazione di un prodotto bianco traballante. Il fosforo (il reagente in questo caso) non era solubile in acqua, ma il prodotto era, quindi ha raccolto il prodotto con molta attenzione, separandolo dal fosforo non reagito lavandolo con acqua. Dopo l’essiccazione, poteva misurare quanto fosforo aveva bruciato, quanto ossigeno era stato consumato (perché conosceva la densità del gas ossigeno) e quanto prodotto si era formato., Ha scoperto che la massa del prodotto era la somma delle masse di reagente consumate, in ogni esperimento. Questa è la legge di conservazione della massa (che, in realtà, anche alcuni alchimisti e chimici precedenti avevano usato). Ha anche osservato che il fosforo non ha sapore, ma il prodotto, che ha chiamato acido fosforico, è acido. Sapeva da questi esperimenti che in molti casi gli elementi si combinano solo in determinate proporzioni, e anche che l’ossigeno può combinarsi con zolfo, fosforo, ecc., Ci ha dato la terminologia che usiamo ancora oggi: l’acido solforico è composto da zolfo e più ossigeno, l’acido solforoso è composto da zolfo e meno ossigeno. – ous significa meno ossigeno; – ic significa più ossigeno. Vedere la pagina nomenclatura per i dettagli.
Lavoisier ha prestato molta attenzione alla precisione e alla precisione. Ad esempio, nell’esperimento che abbiamo appena descritto, ha misurato il volume di gas nel vaso campanario, prima e dopo la reazione, ma ha notato che dopo la reazione, è necessario attendere che la temperatura ritorni a quella che era quando si misurava originariamente., Se il gas è caldo quando si misura il suo volume dopo la reazione, si sarà espanso e la densità standard non si applicherà. Ciò introdurrebbe un errore sistematico nelle misurazioni: ogni volta che esegui l’esperimento, penserai che c’è più gas rimasto di quello che c’è in realtà, e la tua misurazione non sarà accurata. Se il risultato medio del tuo esperimento è vicino al valore corretto, è accurato. Tuttavia, se il tuo esperimento fornisce numeri molto diversi ogni volta, anche se la media è corretta e l’esperimento è accurato, non è preciso., La precisione è la differenza tra l’incontro “intorno alle 2″ e l’incontro ” a 3 minuti e 27 secondi prima delle 2 di sera.”La precisione è quanto sei specifico, quanti dettagli usi. Lavoisier ha anche contribuito a sviluppare il sistema di unità (kg, L, m) che sono attualmente in uso in Corea e in molti altri paesi.

in Generale, mentre non è stato molto numerosi esperimenti che nessun altro aveva fatto prima, ha fatto i suoi esperimenti con cura, erano quanto di più accurato e preciso possibile, e poi ha pensato a loro con chiarezza e creata parole per descrivere i prodotti chimici e le idee che hanno contribuito a rendere tutto più chiaro., Se leggi un libro di testo di chimica scritto prima di Lavoiser, sarai molto confuso perché i nomi delle sostanze chimiche sarebbero basati sulla storia (e suonerebbero come se provenissero da Harry Potter), piuttosto che essere basati su ciò che le sostanze chimiche sono. Se leggi un testo di chimica scritto dopo Lavoiser, riconoscerai la lingua come simile a quella che usiamo oggi.
Sommario
La precisione descrive la vicinanza di un valore misurato al valore effettivo. Precisione descrive quanto bene un gruppo di valori misurati sono d’accordo con l’altro., La legge di conservazione della massa afferma che la materia non può essere creata né distrutta da un processo chimico o fisico. Ciò si traduce nella somma delle masse di reagente consumate in qualsiasi esperimento è uguale alla massa del prodotto. I cambiamenti chimici comportano la modifica dell’identità chimica di una sostanza in modo tale che si formino nuove sostanze. I cambiamenti fisici comportano l’alterazione di una sostanza senza modificarne l’identità chimica. La combustione e la ruggine sono due esempi di processi chimici mentre l’ebollizione e la fusione sono esempi di processi fisici., Le reazioni chimiche comportano la trasformazione di reagenti, sostanze chimiche che vengono consumate nel processo di cambiamento chimico, in prodotti, sostanze chimiche prodotte attraverso il processo di cambiamento chimico che hanno una composizione diversa dai reagenti. Un reagente limitante determina, o limita, la quantità di prodotto che può essere prodotto da una reazione chimica.
Collegamento esterno
- CrashCourse Chemistry: The Fundamental Law (11 min)
Contributori e attribuzioni
-
Emily V Eames (City College of San Francisco)