Introduzione
La sindrome dell’ovaio policistico (PCOS) è uno dei disturbi più comuni dell’endocrinologia nelle donne in età riproduttiva. La PCOS viene diagnosticata confermando la presenza di due dei seguenti: oligo-e/o anovulazione, iperandrogenismo clinico e / o biochimico e caratteristiche ecografiche delle ovaie policistiche, con l’esclusione di altre eziologie (Fr e Tarlatzis, 2004)., I tassi di prevalenza di PCOS dipendono dai criteri diagnostici utilizzati, ma possono arrivare fino al 18% quando si utilizzano i criteri diagnostici di Rotterdam (Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group, 2004). L’iperandrogenismo si trova nel 60-80% delle donne con PCOS (Azziz et al., 2006). Le principali caratteristiche cliniche o biochimiche dell’iperandrogenismo sono l’acne, l’irsutismo, l’alopecia e la dermatite seborroica; livelli elevati di testosterone, androstenedione e deidroepiandrosterone solfato; e livelli ridotti di globulina legante l’ormone sessuale (SHBG)., La sindrome non solo presenta manifestazioni riproduttive ma ha anche implicazioni metaboliche tra cui insulino-resistenza, dislipidemia, obesità, diabete di tipo 2 e infiammazione sistemica (Deugarte et al., 2005; Sartor e Dickey, 2005; Escobar-Morreale et al., 2011).
Mentre il trattamento di prima linea per l’induzione dell’ovulazione nelle donne con PCOS è la somministrazione di citrato di clomifene, si pensa che gli effetti antiestrogenici del citrato di clomifene sull’endometrio e sul muco cervicale causino un basso tasso di concepimento del 20% (Gonen e Casper, 1990)., Il citrato di clomifene è anche associato a una serie di effetti collaterali tra cui vampate di calore, fastidio al seno, distensione addominale, nausea, vomito, nervosismo, mal di testa, perdita di capelli e visione disturbata (Legro et al., 2007a). Studi recenti hanno studiato il ruolo della metformina come agente sensibilizzante all’insulina e, sebbene il suo uso sia in aumento, la comprensione del suo meccanismo è incompleta (Legro et al., 2007b)., Inoltre, può causare lo sviluppo di follicoli multipli, insieme a un rischio di iperstimolazione ovarica, gravidanze multiple e malformazioni congenite come difetti del tubo neurale, portando così a risultati di trattamento potenzialmente insoddisfacenti.
Poiché la PCOS è definita come un disturbo metabolico-endocrino multifattoriale (Laven et al., 2002), stile di vita e dieta, e la dieta mediterranea in particolare, svolgono un ruolo rilevante, insieme al trattamento farmacologico (Barrea et al., 2019)., Studi recenti hanno suggerito che trattamenti complementari e alternativi, tra cui medicinali a base di erbe e agopuntura, possono alleviare i sintomi della PCOS, ma la prova della loro efficacia e sicurezza è insufficiente. Pertanto, nuove strategie di trattamento che incorporano terapie complementari e alternative devono essere studiate per ottimizzare il trattamento della PCOS. In questo studio, abbiamo esaminato i dati sugli effetti e sui meccanismi sottostanti dei medicinali a base di erbe utilizzati nel trattamento del modello PCOS in studi di laboratorio.,
Metodi
Gli articoli pubblicati in inglese fino al 30 giugno 2018 sono stati cercati in Medline (via PubMed) e EMBASE (via Elsevier). I termini di ricerca erano una combinazione di termini di intestazione del soggetto medico (MeSH) e dei loro sinonimi. I termini di ricerca utilizzati sono stati i seguenti: E .
I criteri di inclusione della nostra recensione includevano quanto segue:
1. Studi in vitro e in vivo che hanno valutato i potenziali effetti dei medicinali a base di erbe sul modello PCOS
2., Ricerca sui composti isolati da erbe, singoli estratti di erbe o decotti a base di erbe
3. Articoli scritti in inglese
I criteri di esclusione erano i seguenti:
1. Studi clinici di medicinali a base di erbe per PCOS
2. Recensione articoli
3., Articoli che non descrivevano i componenti della fitoterapia; tuttavia, questo è stato permesso nel caso di medicinali a base di erbe brevettati
Tra gli studi recuperati, dopo aver rimosso i duplicati, i titoli e gli abstract sono stati esaminati per trovare articoli potenzialmente rilevanti. Quindi, i testi completi degli articoli esaminati sono stati esaminati per confermare che soddisfacevano i nostri criteri di inclusione.,
Abbiamo estratto dati riguardanti l’intervento a base di erbe; uso delle cellule bersaglio (o modello animale); metodo di estrazione a base di erbe: via di somministrazione; dosaggio e periodi; e risultati dei composti isolati da erbe, singoli estratti di erbe e decotti a base di erbe. Sulla base di questi dati, abbiamo riassunto le azioni e i meccanismi alla base degli effetti benefici dei medicinali a base di erbe sul modello PCOS.
Risultati
Caratteristiche dello studio
Nella presente revisione, abbiamo incluso un totale di 27 studi che coinvolgono 22 medicinali a base di erbe che hanno riportato la loro efficacia sul modello PCOS., Abbiamo identificato due studi in vitro, 22 studi in vivo e tre studi con esperimenti sia in vitro che in vivo. Gli interventi a base di erbe negli studi 27 comprendevano quattro composti isolati dalle erbe (studi 6), nove singoli estratti di erbe (studi 11) e nove decotti a base di erbe (studi 10). Un diagramma di flusso del processo di selezione dell’articolo è mostrato in Figura 1.
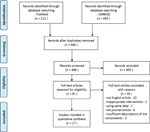
Figura 1 Diagramma di flusso del processo di selezione dello studio.,
Interventi a base di erbe e loro risultati di laboratorio
Composti isolati da erbe
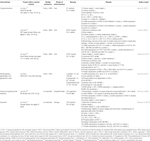
Tabella 1 Studi in vitro e in vivo di composti isolati da erbe (n=6).
Estratti di erbe individuali
Aloe vera (L.) Burm.f. livelli plasmatici ridotti di colesterolo totale (TC), trigliceridi (TG) e colesterolo lipoproteico a bassa densità (LDL-C); livelli elevati di colesterolo lipoproteico ad alta densità (HDL-C) (Desai et al.,, 2012); crescita follicolare normalizzata; e recuperato il ciclo estrale (Maharjan et al., 2010). Atractylodes macrocephala Koidz. indotto il recupero del ciclo estroso e la riduzione dei livelli di testosterone, i livelli di androstenedione, l’indice androgeno libero, i livelli di LH, il rapporto LH / FSH e i livelli ormonali anti-mülleriani (Zhou et al., 2016). Le femmine di Wistar trattate con Matricaria chamomilla L. hanno mostrato una diminuzione delle cisti nel tessuto ovarico e un aumento del numero di follicoli dominanti (Zangeneh et al., 2010). Cocos nucifera L., recuperato il ciclo estrale; ridotto TC, livelli di colesterolo e TG a densità molto bassa; e aumento dei livelli di HDL-C (Soumya et al., 2014). Ratti femmina SD trattati con Linum usitatissimum L. hanno mostrato un aumento dei follicoli antrali e del corpo luteo, un numero ridotto di follicoli cistici e un diametro ridotto dei follicoli antrali (Jelodar et al., 2018). Foeniculum vulgare Mill. glomerulo normale indotto, membrana basale normale e capillari (Sadrefozalayi e Farokhi, 2014)., Zingiber officinale Roscoe ha abbassato i livelli di LH e di estrogeni e ha aumentato i livelli di FSH e progesterone nei ratti SD femminili neonatali (Atashpour et al., 2017). Ginseng rosso coreano (Panax ginseng C. A. Mey.)- ratti femmina trattati con SD hanno mostrato meno follicoli cistici e l’espressione di mRNA di NGF nelle ovaie (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata ha migliorato la velocità di infusione del glucosio e ridotto i livelli di TC e TG (Mannerås et al., 2010). I dati sono riassunti nella tabella 2.,
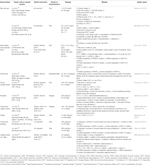
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Chinese herbal medicine (CHM) 1 (Root Astragali Root Rehmanniae Preparata, Cuscuta me of chinese Lam, Fruit Lives Lucidi, Fruit Psoraleae, the Root of Salviae Miltiorrhizae, and raspberry Linn) e CHM 2 (Cuscuta me of chinese Lam, Fruit Lives Lucidi, and raspberry Linn) hanno indotto il recupero del ciclo estrale e del rapporto LH/FSH e la riduzione dei livelli di androstenedione e dell’indice androgeno libero (Gu et al., 2015)., La formula Gui Zhu Yi Kun (GZYKF) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia e Luffa cilindrica) ha ridotto le espressioni di mRNA di Beclin 1, light chain 3 e tumor suppressor p53 (Xing et al., 2017). I ratti femmina trattati con EMOHIM (Angelica Radix, Cnidii Rhizoma e Paeonia Radix) hanno mostrato un aumento del numero e delle dimensioni dei corpi lutei e una diminuzione del livello di proteina NGF nelle ovaie (Kim et al., 2009). Heqi san è stato trovato per ridurre i livelli di LH e testosterone e per mitigare la resistenza all’insulina (Zhao et al., 2017)., Un nuovo farmaco immunomodulatore a base di erbe (IMOD) (Rosa canina, Urtica dioica e Tanacetum vulgare)-ratti albini Wistar femminili trattati hanno mostrato meno incidenze di follicoli atretici e cistici ovarici e un numero maggiore di corpi lutei (Rezvanfar et al., 2012). La somministrazione di Kyung-Ok-Ko (KOK) ha indotto il recupero del ciclo estroso e del cluster di differenziazione (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, proteina chemoattrattante monocitaria (MCP)-1 e riduzione dell’espressione dell’mRNA iNOS nelle ovaie di ratti femmina SD (Jang et al., 2014; Lee et al., 2016)., Femmina SD ratti trattati con Xiao-Yao-San (XYS) (radix bupleuri, angelica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, zenzero, menta, e glycyrrhizae) ha mostrato un ridotto numero di follicoli cistici e abbassato terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) cellule positive nei follicoli antrali (Sun et al., 2017). I dati sono riassunti nella tabella 3.

Tabella 3 Studi in vitro e in vivo di decotti a base di erbe (n=10).,
Le azioni dei medicinali a base di erbe per il trattamento della PCOS

Tabella 4 Le azioni dei medicinali a base di erbe per il trattamento della PCOS.
I meccanismi di azione per PCOS

Tabella 5 I meccanismi di azione dei medicinali a base di erbe su PCOS.,
Discussione
La nostra recensione della letteratura pubblicata fino al 30 giugno 2018 ha riassunto i risultati degli studi in vitro e in vivo sull’efficacia dei medicinali a base di erbe per il trattamento del modello PCOS. Un totale di quattro composti isolati dalle erbe (6 studi), nove singoli estratti di erbe (11 studi) e nove decotti a base di erbe (10 studi) hanno avuto effetti inibitori sulla PCOS., Secondo i risultati riportati, le medicine a base di erbe hanno normalizzato gli ormoni femminili, diminuito gli ormoni maschili, recuperato il ciclo estrale, migliorato la resistenza all’insulina e migliorato il metabolismo dei lipidi. Abbiamo scoperto che la potenziale attività inibitoria delle medicine a base di erbe potrebbe influenzare diversi aspetti della PCOS, con gli effetti benefici delle medicine a base di erbe derivanti principalmente attraverso l’anti-infiammazione, lo stress antiossidante, l’inibizione dell’autofagia o dell’apoptosi e la riduzione dell’NGF ovarico.,
I medicinali a base di erbe possono inibire le condizioni infiammatorie della PCOS
Studi recenti hanno ulteriormente esplorato l’eziologia e la patologia della PCOS. Gli scienziati hanno scoperto che nel microambiente dei pazienti con PCOS, una lieve infiammazione cronica è un segno distintivo della sindrome (Nestler, 2000). La PCOS è stata rilevante nell’infiammazione cronica (Benson et al., 2008), e i macrofagi sono stati la sua principale patogenesi (Wu et al., 2004). I macrofagi ovarici producono citochine, chemochine e fattori di crescita sia nei processi normali che infiammatori dell’ovaio., I macrofagi possono orchestrare l’apoptosi e il rimodellamento dei tessuti, che sono coinvolti nella folliculogenesi, nell’ovulazione e nella formazione del corpo luteo (Benson et al., 2008). Dato il ruolo critico dei macrofagi nella PCOS (Benson et al., 2008), numerosi studi hanno confrontato i livelli di citochine nel siero e nei fluidi follicolari nei pazienti con PCOS. I livelli di TNF-α e IL-6 nel siero e nei fluidi follicolari sono stati elevati nei pazienti con PCOS non obesi/non diabetici trattati con gonadotropine (Amato et al., 2003)., La proteina infiammatoria dei macrofagi-1α e la MCP-1 erano aumentate nei pazienti con PCOS e associate all’adiposità (Glintborg et al., 2009). iNOS, cicloossigenasi-2 (COX-2) e fattore di crescita trasformante (TGF)-β attività sono stati aumentati nelle ovaie dei pazienti con PCOS (Elia et al., 2006; Hatzirodos et al., 2011), e l’attività iNOS e COX-2 sono state prevenute dalla somministrazione di metformina (Elia et al., 2006). Questi risultati suggeriscono che il sistema immunitario è rilevante per la patogenesi della PCOS., Pertanto nuovi rimedi mirati a questo processo infiammatorio possono essere un’alternativa terapeutica al trattamento attuale.
In questa recensione, gli iridoidi hanno inibito significativamente l’espressione di IL-1β, IL-6, IL-10 e iNOS, inibendo così le condizioni infiammatorie (Zuo et al., 2017). La quercetina ha anche ridotto significativamente i livelli di IL-1β, IL-6 e TNF-α e ha ridotto la traslocazione nucleare del fattore nucleare kappa B (NF-kB) in un modello di ratto PCOS insulino-resistente (Wang et al., 2017)., La pre-somministrazione di KOK ha diminuito l’aumentata espressione dei macrofagi ionizzati della molecola adattatore legante il calcio -1 (+) nello strato cellulare della teca delle cisti e dello stroma. KOK ha anche aumentato l’espressione di mRNA di CD11b e CD3 nel tessuto ovarico PCOS. La pre-somministrazione di KOK ha ridotto significativamente i livelli aumentati di IL-1β, IL-6, IL-8, TNF-α, MCP-1 e iNOS; e ha aumentato la ridotta espressione di mRNA del fattore di crescita epidermico e TGF-β nelle ovaie PCOS., Questi risultati hanno dimostrato che KOK regola l’espressione dei mediatori infiammatori nel modello PCOS indotto da deidroepiandrosterone (DHEA) (Jang et al., 2014). I mediatori infiammatori sono stati regolati anche nell’endometrio dell’utero dalla somministrazione di KOK, che ha dimostrato di prevenire l’iperplasia endometriale nei modelli PCOS (Lee et al., 2016). È stato anche dimostrato che il TNF-α nel siero e la prostaglandina E (PGE) nell’ovaio erano diminuiti dagli IMODi (Rezvanfar et al., 2012).,
I medicinali a base di erbe possono attenuare lo stress ossidativo in PCOS
Le specie reattive dell’ossigeno sono importanti molecole di segnale nella regolazione delle funzioni fisiologiche nella riproduzione femminile, tra cui steroidogenesi, folliculogenesi, maturazione degli ovociti, funzione del corpo luteo e luteolisi (Agarwal et al., 2005). Inoltre, svolgono un ruolo chiave nei processi patologici della riproduzione femminile (Agarwal et al., 2003; Agarwal et al., 2008)., Lo stress ossidativo è una condizione in cui l’equilibrio tra la capacità antiossidante del corpo e i prodotti tossici derivati dall’ossigeno e/o dall’azoto è compromesso. Di conseguenza, i radicali liberi non sono sufficientemente disintossicati dagli antiossidanti cellulari. Lo stress ossidativo svolge un ruolo importante nella riproduzione femminile (Ruder et al., 2008; Ruder et al., 2009; Vakilian et al., 2009), e c’è una crescente letteratura sugli effetti dell’aumento dei marcatori dello stress ossidativo nelle femmine infertili e sul loro coinvolgimento nella fisiopatologia della PCOS (Joo et al., 2010; Mohamadin et al., 2010)., PCOS è caratterizzato da infiammazione cronica, stress ossidativo e espressione anormale dei microRNA (Zhao et al., 2015; Zuo et al., 2016). Poiché è noto che l’infiammazione e lo stress ossidativo sono strettamente collegati, lo stress ossidativo elevato di solito deriva da e porta a una condizione infiammatoria (Zuo et al., 2016). È difficile separare l’infiammazione dallo stress ossidativo, ed è stato proposto negli ultimi anni che l’infiammazione e lo stress ossidativo costituiscono il fondamento principale dell’insorgenza della malattia (Duleba e Dokras, 2012).
In questa recensione, IMODs (Rezvanfar et al.,, 2012) e iridoidi (Zuo et al., 2017) ha mostrato effetti positivi sullo stress ossidativo / nitrosativo, direttamente o indirettamente, principalmente riducendo i radicali liberi e inibendo le citochine infiammatorie nei ratti PCOS. La somministrazione di IMOD ha ridotto significativamente la perossidazione lipidica (un marker dello stress ossidativo) e ha aumentato i livelli di superossido dismutasi, catalasi e glutatione perossidasi (marcatori del potenziale antiossidante) nei PCOS indotti dall’iperandrogenismo. Inoltre, i livelli di perossinitrite (un marker di stress nitrosativo), TNF-α e PGE sono stati significativamente ridotti dagli IMOD., Inoltre, questi effetti degli IMOD sono stati coerenti con l’evidenza istologica, che ha mostrato un miglioramento significativo delle caratteristiche microscopiche della folliculogenesi rispetto a quelle del gruppo di controllo (Rezvanfar et al., 2012). Il sistema di segnalazione NF-kB è noto come paradigma dominante per specifiche molecole di trasduzione del segnale, attivazione genica e proteine regolatrici in risposta all’infiammazione (Ivanenkov et al., 2011)., Gli iridoidi hanno attenuato efficacemente l’elevazione indotta dal lipopolisaccaride dei livelli di fosforilazione di IkB, hanno diminuito i livelli di espressione di IkB e hanno diminuito NF-kB P65, indicando che gli iridoidi esercitano i loro effetti antiossidanti tramite la via NF-kB (Zuo et al., 2017).
I medicinali a base di erbe possono regolare l’apoptosi e/o l’autofagia nella PCOS
La sopravvivenza o la morte delle cellule della granulosa è riconosciuta come un fattore critico che influisce sul destino dei follicoli (Matsuda et al., 2012). L’apoptosi e l’autofagia sono due forme di morte cellulare programmata., L’autofagia è il processo mediante il quale un autofagosoma, che è una vescicola a doppia membrana, trasporta materiale citoplasmatico al lisosoma (Mizushima e Komatsu, 2011). È stato riportato che sia l’apoptosi che l’autofagia possono essere indotte nelle cellule della granulosa e che sono coinvolte nel controllo dello sviluppo follicolare (Choi et al., 2010; Choi et al., 2013). Le cellule della granulosa sono riconosciute come attori critici nello sviluppo del follicolo. Producono estradiolo, fattori di crescita insulino-simili e altre citochine nell’ovaio ed esprimono i recettori per estradiolo, LH e FSH (Juengel et al.,, 2006), che partecipano tutti alla regolazione dello sviluppo del follicolo. Pertanto, qualsiasi compromissione delle cellule della granulosa può provocare uno sviluppo disordinato dei follicoli.
Nell’ultimo decennio sono state identificate le vie di segnalazione correlate all’autofagia e i loro principali regolatori proteici. La catena leggera della proteina 1 associata ai microtubuli di ratto 3 è associata all’elaborazione della membrana autofagosoma (Kabeya et al., 2000). Beclin-1 ha anche dimostrato di avere un ruolo critico nella formazione di autofagosomi (Von Hoven et al., 2012)., Inoltre, studi precedenti hanno identificato il soppressore tumorale p53 (p53) come un doppio modulatore di autofagia nella regolazione della morte o della sopravvivenza cellulare (Vousden e Ryan, 2009; Zhang et al., 2010). A bassi livelli di energia, la chinasi proteica attivata dall’adenosina monofosfato (AMPK), che viene attivata da p53, è in grado di attivare il complesso della sclerosi tuberosa 2 e quindi inibire l’obiettivo dei mammiferi della rapamicina (mTOR) attività e aumentare l’autofagia (Feng et al., 2007)., In questa recensione, p53, che viene attivato da GZYKF nel nucleo, a sua volta ha attivato AMPK e sestrin, agendo come feedback nell’inibizione di mTOR, attivando così l’autofagia. L’autofagia è anche modulata dalle vie di segnalazione della fosfoinositide 3-chinasi/protein chinasi B (PI3K/Akt) (Pyo et al., 2012). In questa recensione, XYS ha alleviato la riduzione della fosforilazione della proteina ribosomiale S6 chinasi polipeptide I e Akt, così come l’aumento della catena leggera della proteina associata ai microtubuli 3-I alla conversione della catena leggera della proteina associata ai microtubuli 3-II sia in vivo che in vitro (Sun et al., 2017).,
L’endometrio della maggior parte dei pazienti con PCOS è spesso e presenta iperplasia semplice, complicata o atipica o trasformazione maligna che può essere correlata con l’apoptosi delle cellule endometriali (Villavicencio et al., 2007). L’iperandrogenismo indotto dal DHEA è associato a un maggior numero di cellule apoptotiche nell’endometrio e la metformina (un agente insulinomimetico o insulino-sensibilizzante) è in grado di ridurre l’aumento del numero di cellule apoptotiche (Elia et al., 2009). In questa revisione, la morte cellulare apoptotica è stata valutata mediante colorazione TUNEL., Le cellule apoptotiche sono state raramente rilevate dalla colorazione di TUNEL nel tessuto uterino del gruppo sham o KOK-alone. Tuttavia, il numero di cellule TUNEL-positive è aumentato nell’endometria del gruppo DHEA. L’aumento del numero di cellule apoptotiche è stato significativamente ridotto dopo la somministrazione di KOK. Questi risultati indicano che la pre-somministrazione di KOK ha inibito la malformazione endometriale indotta da DHEA riducendo l’apoptosi endometriale (Lee et al., 2016).,
I medicinali a base di erbe possono ridurre il livello di NGF nella PCOS
Studi precedenti hanno dimostrato che la PCOS è associata ad un’attivazione anormale del sistema nervoso simpatico, con conseguente aumento dei nervi catecolaminergici (Semenova, 1969), alterato metabolismo della norepinefrina (Garcia-Rudaz et al., 1998) e aumento dell’attività dei nervi simpatici attraverso il nervo ovarico superiore (Lara et al., 1993)., Lo sviluppo e la funzione dell’innervazione simpatica ovarica dipendono dall’ovaio per la produzione di NGF, una neurotrofina derivata dall’obiettivo necessaria per lo sviluppo del sistema simpatico periferico (Levi-Montalcini, 1987). La famiglia delle neurotrofine, coinvolge il recettore NGF e l’mRNA NGF nell’ovulazione e nella fisiopatologia della PCOS (Lara et al., 2000; Stener-Victorin et al., 2003). Nelle ovaie di ratto, l’NGF è sintetizzato principalmente nelle cellule della parete follicolare (Dissen et al.,, 1996), e in PCOS, l’attivazione di NGF può essere un fattore coinvolto nel migliorare il deflusso della noradrenalina alla ghiandola, che è indotta da estradiolo valerato (EV) (Lara et al., 2000) PCOS presenta un’alta densità di fibre nervose intraovariane che è associata all’iperresponsività simpatica (Stener-Victorin et al., 2003).
In questa recensione, la somministrazione delle formule a base di erbe Changbudodam-Tang e Yongdamsagan-Tang ha ridotto significativamente l’NGF elevato nelle ovaie con scarso effetto sul tessuto cerebrale (Lee et al., 2003)., HemoHIM ha anche normalizzato l’NGF, abbassato l’alto numero di follicoli antrali e aumentato il numero di corpi lutei in PCOS. Questi risultati sono coerenti con quelli di precedenti studi sugli effetti benefici di HemoHIM nella prevenzione e nel trattamento della PCOS (Pak et al., 2009). Inoltre, la somministrazione di estratto di ginseng rosso coreano (Pak et al., 2009; Jung et al., 2011) e saponine totali di ginseng rosso coreano (Pak et al., 2005) ha diminuito significativamente l’espressione della proteina NGF e dell’mRNA NGF, rispetto a quelli nelle ovaie trattate con EV.,
Questo studio ha esaminato le prove per i medicinali a base di erbe che possono essere usati per trattare la PCOS e i suoi sintomi associati, e i risultati hanno lo scopo di aggiungere alla comprensione dei medici dei meccanismi d’azione dei medicinali a base di erbe nel trattamento della PCOS. Il limite principale del nostro studio è l’eterogeneità degli interventi. Inoltre, il nostro studio non ha eseguito una valutazione della qualità di ogni studio o una sintesi quantitativa dei risultati. Ulteriori studi che includono la valutazione della qualità metodologica e la sintesi quantitativa dei risultati sono giustificati.,
Conclusione
In questa recensione, un totale di 27 studi che hanno coinvolto 22 medicinali a base di erbe hanno mostrato effetti benefici sulla PCOS. Gli interventi a base di erbe negli studi 27 comprendevano quattro composti isolati dalle erbe (studi 6), nove singoli estratti di erbe (studi 11) e nove decotti a base di erbe (studi 10). I medicinali a base di erbe hanno dimostrato di normalizzare gli ormoni femminili, diminuire gli ormoni maschili, recuperare il ciclo estrale, migliorare la resistenza all’insulina e migliorare il metabolismo lipidico in PCOS., I meccanismi alla base degli effetti benefici dei medicinali a base di erbe sulla PCOS sono associati a anti-infiammazione, stress antiossidante, inibizione dell’autofagia e/o apoptosi e riduzione dell’NGF ovarico. Le medicine a base di erbe possono essere considerate risorse promettenti nello sviluppo di agenti terapeutici efficaci per la PCOS.
Contributi dell’autore
I-HC e KP hanno progettato lo studio. C-YK e KP hanno cercato gli articoli e analizzato i dati. KP ha scritto il manoscritto e I-HC rivisto. Tutti gli autori hanno contribuito all’articolo e hanno approvato la versione presentata.,
Finanziamento
Questo lavoro è stato sostenuto dalla National Research Foundation of Korea (NRF) sovvenzione finanziata dal governo della Corea (MSIP) (No.NRF-2017R1C1B1006387) e la Società coreana di Ginseng (2019).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE / ASRM-Sponsorizzato PCOS Consensus Workshop Group (2004). Consenso rivisto del 2003 sui criteri diagnostici e sui rischi per la salute a lungo termine legati alla sindrome dell’ovaio policistico. Fertilità Sterilità 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Full Text/Google Scholar
Semenova, I. (1969). Innervazione adrenergica delle ovaie nella sindrome di Stein-Leventhal. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar