Un catalizzatore è una sostanza che accelera una reazione chimica, ma non viene consumata dalla reazione; quindi un catalizzatore può essere recuperato chimicamente invariato alla fine della reazione che è stato usato per accelerare o catalizzare.

Discussione
Affinché le sostanze chimiche reagiscano, i loro legami devono essere riorganizzati, perché i legami nei prodotti sono diversi da quelli nei reagenti.,Il passo più lento nel riarrangiamento del legame produce quello che viene definito uno stato di transizione-una specie chimica che non è né un reagente né un prodotto, ma è un intermedio tra i due.
L’energia è necessaria per formare lo stato di transizione. Questa energia è chiamata energia di attivazione, o Ea.Leggendo il diagramma qui sotto da sinistra a destra mostra il progresso di una reazione come reagenti passano attraverso lo stato di transizione per diventare prodotti.,
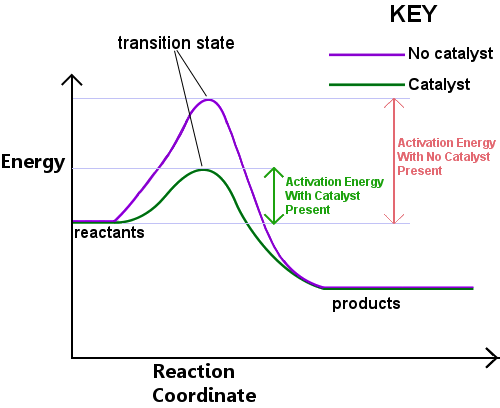
L’energia di attivazione può essere pensata come una barriera a una reazione chimica, un ostacolo che deve essere superato.Se la barriera è alta, poche molecole hanno energia cinetica sufficiente per scontrarsi, formare uno stato di transizione e attraversare la barriera.I reagenti con energia inferiore a Ea non possono passare attraverso lo stato di transizione per reagire e diventare prodotti.
Un catalizzatore funziona fornendo un percorso diverso, con Ea inferiore, per la reazione. I catalizzatori abbassano la barriera energetica.,Il diverso percorso consente che i riarrangiamenti dei legami necessari per convertire i reagenti in prodotti avvengano più facilmente, con una minore energia input.In ogni dato intervallo di tempo, la presenza di un catalizzatore consente a una percentuale maggiore delle specie reagenti di raccogliere energia sufficiente per passare attraverso lo stato di transizione e diventare prodotti.
Esempio 1: Il processo Haber
Il processo Haber, che viene utilizzato per produrre ammoniaca da idrogeno e azoto, è catalizzato dal ferro, che fornisce siti atomici su cui i legami reagenti possono riorganizzarsi più facilmente per formare lo stato di transizione.,
Esempio 2: Enzimi
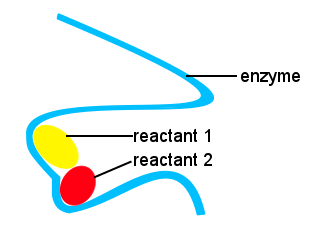
Nel nostro corpo e in altri esseri viventi, gli enzimi sono usati per accelerare le reazioni biochimiche. Un enzima è un tipo di catalizzatore.La vita complessa sarebbe impossibile senza gli enzimi per permettere che le reazioni avvengano alle velocità adatte.Le forme degli enzimi e le posizioni sull’enzima che si legano ai reagenti forniscono una via di reazione alternativa, consentendo a molecole specifiche di riunirsi per formare uno stato di transizione con una barriera energetica di attivazione ridotta.,
Nello schema seguente, l’enzima a catena lunga fornisce siti per molecole reagenti di venire insieme per formare uno stato di transizione con una bassa energia di attivazione.
I catalizzatori non possono spostare la posizione di un equilibrio chimico – le reazioni avanti e indietro sono entrambe accelerate in modo che la costante di equilibrio Keq sia invariata.Tuttavia, rimuovendo i prodotti dalla miscela di reazione mentre si formano, il tasso complessivo di formazione del prodotto può in pratica essere aumentato.