Un acetale è un gruppo funzionale con la connettività R2C (OR’)2). Qui, i gruppi R possono essere frammenti organici (un atomo di carbonio, con altri atomi arbitrari collegati a quello) o idrogeno, mentre i gruppi R’ devono essere frammenti organici non idrogeno. I due gruppi R ‘possono essere equivalenti tra loro (un” acetale simmetrico”) o meno (un”acetale misto”)., Gli acetali sono formati e convertibili in aldeidi o chetoni e hanno lo stesso stato di ossidazione al carbonio centrale, ma hanno sostanzialmente diversa stabilità chimica e reattività rispetto agli analoghi composti carbonilici. L’atomo di carbonio centrale ha quattro legami ad esso, ed è quindi saturo e ha geometria tetraedrica.,

Generica struttura di acetali
Il termine ketal a volte è usato per identificare strutture associate con chetoni (R gruppi di frammenti organici, piuttosto che di idrogeno) piuttosto che aldeidi e, storicamente, il termine acetalica è stata utilizzata specificamente per l’aldeide casi relativi (avendo almeno uno di idrogeno al posto di una R sul carbonio centrale). L’IUPAC originariamente deprecato l’uso della parola ketal del tutto, ma da allora ha invertito la sua decisione., Tuttavia, in contrasto con l’uso storico, i chetali sono ora un sottoinsieme di acetali, un termine che ora comprende sia le strutture derivate dall’aldeide che dal chetone.
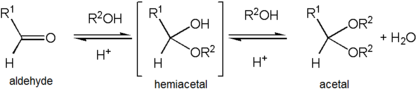
Se uno dei gruppi R ha un ossigeno come primo atomo (cioè, ci sono più di due ossigeni single-bonded al carbonio centrale), il gruppo funzionale è invece un orto. In contrasto con le variazioni di R, entrambi i gruppi R ‘ sono frammenti organici. Se uno R ‘ è un idrogeno, il gruppo funzionale è invece un emiacetale, mentre se entrambi sono H, il gruppo funzionale è un idrato chetonico o idrato aldeidico.,
La formazione di un acetal succede quando il gruppo hydroxyl di un hemiacetal diventa protonated e è perso come acqua. Il carbocation che viene prodotto viene quindi rapidamente attaccato da una molecola di alcol. La perdita del protone dall’alcool allegato dà l’acetale.,
Acetals are stable compared to hemiacetals but their formation is a reversible equilibrium as with esters., Come reazione per creare un ricavato acetale, l’acqua deve essere rimossa dalla miscela di reazione, ad esempio con un apparato Dean–Stark, affinché non idrolizzi il prodotto nell’emiacetale. La formazione di acetali riduce il numero totale di molecole presenti (carbonile + 2 alcool → acetale + acqua) e quindi non è generalmente favorevole per quanto riguarda l’entropia. Una situazione in cui non è entropicamente sfavorevole è quando viene utilizzata una singola molecola di diolo piuttosto che due molecole di alcol separate (carbonile + diolo → acetale + acqua)., Un altro modo per evitare il costo entropico è quello di eseguire la sintesi per scambio acetale, utilizzando un reagente di tipo acetale preesistente come donatore del gruppo OR piuttosto che la semplice aggiunta di alcoli stessi. Un tipo di reagente utilizzato per questo metodo è un orto. In questo caso, l’acqua prodotta insieme al prodotto acetale viene distrutta quando idrolizza le molecole ortoesteriche residue e questa reazione laterale produce anche più alcol da utilizzare nella reazione principale.,
Gli acetali sono utilizzati come gruppi protettivi per i gruppi carbonilici in sintesi organica perché sono stabili rispetto all’idrolisi da parte delle basi e rispetto a molti agenti ossidanti e riducenti. Possono proteggere il carbonile in una molecola (reagendolo temporaneamente con un alcool) o un diolo (reagendolo temporaneamente con un carbonile). Cioè, il carbonile, o gli alcoli, o entrambi potrebbero essere parte della molecola la cui reattività deve essere controllata.
Vari composti carbonilici specifici hanno nomi speciali per le loro forme acetali., Ad esempio, un acetale formato da formaldeide (due idrogeni attaccati al carbonio centrale) è talvolta chiamato un gruppo formale o metilendiossi. L’acetale formato da acetone è talvolta chiamato acetonide.