Introducción
el síndrome de ovario poliquístico (SOP) es uno de los trastornos más comunes de la endocrinología en mujeres en edad reproductiva. El SOP se diagnostica confirmando la presencia de dos de los siguientes: oligo – y/o anovulación, hiperandrogenismo clínico y/o bioquímico, y características ecográficas de ovarios poliquísticos, con exclusión de otras etiologías (Fr y Tarlatzis, 2004)., Las tasas de prevalencia de SOP dependen de los criterios diagnósticos utilizados, pero pueden llegar hasta el 18% cuando se utilizan los criterios diagnósticos de Rotterdam (Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group, 2004). El hiperandrogenismo se encuentra en el 60-80% de las mujeres con SOP (Azziz et al., 2006). Las principales características clínicas o bioquímicas del hiperandrogenismo son acné, hirsutismo, alopecia y dermatitis seborreica; niveles elevados de testosterona, androstenediona y sulfato de dehidroepiandrosterona; y niveles disminuidos de globulina de unión a hormonas sexuales (SHBG)., El síndrome no solo se presenta con manifestaciones reproductivas, sino que también tiene implicaciones metabólicas que incluyen resistencia a la insulina, dislipidemia, obesidad, diabetes tipo 2 e inflamación sistémica (deugarte et al., 2005; Sartor y Dickey, 2005; Escobar-Morreale et al., 2011).
mientras que el tratamiento de primera línea para la inducción de la ovulación en mujeres con SOP es la administración del citrato de clomiphene, los efectos antiestrogenic del citrato de clomiphene en el endometrium y el moco cervical se piensan para causar una tarifa baja de la concepción del 20% (Gonen y Casper, 1990)., El citrato de clomifeno también se asocia con una serie de efectos secundarios que incluyen sofocos, molestias en los senos, distensión abdominal, náuseas, vómitos, nerviosismo, dolor de cabeza, pérdida de cabello y visión alterada (Legro et al., 2007a). Estudios recientes han investigado el papel de la metformina como agente Sensibilizante de la insulina, y aunque su uso está aumentando, la comprensión de su mecanismo es incompleta (Legro et al., 2007b)., Además, puede causar el desarrollo de múltiples folículos, junto con un riesgo de hiperestimulación ovárica, embarazos múltiples y malformaciones congénitas como defectos del tubo neural, lo que conduce a resultados potencialmente insatisfactorios del tratamiento.
dado que el SOP se define como un trastorno metabólico-endocrino multifactorial (Laven et al., 2002), el estilo de vida y la dieta, y la dieta mediterránea en particular, juegan un papel relevante, junto con el tratamiento farmacológico (Barrea et al., 2019)., Estudios recientes han sugerido que los tratamientos complementarios y alternativos, incluidos los medicamentos a base de hierbas y la acupuntura, pueden aliviar los síntomas del síndrome de ovario poliquístico, pero la evidencia de su eficacia y seguridad es insuficiente. Por lo tanto, es necesario investigar nuevas estrategias de tratamiento que incorporen Terapias Complementarias y alternativas para optimizar el tratamiento del SOP. En este estudio, revisamos los datos sobre los efectos y los mecanismos subyacentes de los medicamentos a base de plantas utilizados en el tratamiento del modelo de SOP en estudios de laboratorio.,
métodos
Los Artículos publicados en inglés hasta el 30 de junio de 2018 se buscaron en Medline (vía PubMed) y EMBASE (vía Elsevier). Los Términos de búsqueda fueron una combinación de términos de medical subject heading (MeSH) y sus sinónimos. Los Términos de búsqueda utilizados fueron los siguientes: y .
los criterios de inclusión de nuestra revisión incluyeron los siguientes:
1. Estudios In vitro e in vivo que evaluaron los efectos potenciales de los medicamentos a base de plantas sobre el SOP modelo
2., Investigación sobre los compuestos aislados de hierbas, extractos herbales individuales o decocciones de fórmulas herbales
3. Los criterios de exclusión fueron los siguientes:
1. Ensayos clínicos de medicamentos a base de plantas para el SOP
2. Artículos de revisión
3., Artículos que no describieron los componentes de la medicina herbal; sin embargo, esto fue permitido en el caso de las medicinas herbales patentadas
entre los estudios recuperados, después de eliminar los duplicados, los títulos y resúmenes fueron revisados para encontrar artículos potencialmente relevantes. Luego, se revisaron los textos completos de los artículos seleccionados para confirmar que cumplían con nuestros criterios de inclusión.,
se extrajeron datos sobre la intervención herbal; uso de células diana (o modelo animal); método de extracción herbal: vía de administración; Dosis y períodos; y resultados de los compuestos aislados de hierbas, extractos herbales individuales y decocciones de fórmulas herbales. Con base en esos datos, resumimos las acciones y los mecanismos subyacentes a los efectos beneficiosos de los medicamentos a base de hierbas en el modelo de SOP.
resultados
características del estudio
en la presente revisión, se incluyeron un total de 27 estudios con 22 medicamentos a base de plantas que informaron su eficacia en el modelo de SOP., Se identificaron dos estudios in vitro, 22 estudios in vivo y tres estudios con experimentos tanto in vitro como in vivo. Las intervenciones herbales en los 27 estudios comprendieron cuatro compuestos aislados de hierbas (6 estudios), nueve extractos herbales individuales (11 estudios) y nueve decocciones de fórmulas herbales (10 estudios). En la Figura 1 se muestra un diagrama de flujo del proceso de selección de artículos.
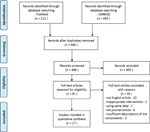
la Figura 1 diagrama de Flujo del estudio proceso de selección.,
intervenciones herbales y sus resultados de laboratorio
compuestos aislados de hierbas
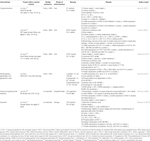
tabla 1 estudios in vitro e in vivo de compuestos aislados de hierbas (n = 6).
extractos herbales individuales
aloe vera (L.) Burm.F. reducción de los niveles plasmáticos de colesterol total (CT), triglicéridos (TG) y colesterol de lipoproteínas de baja densidad (LDL-C); aumento de los niveles de colesterol de lipoproteínas de alta densidad (HDL-C) (Desai et al.,, 2012); crecimiento folicular normalizado; y recuperación del ciclo estral (Maharjan et al., 2010). Atractylodes macrocephala Koidz. indujo la recuperación del ciclo estral y la reducción de los niveles de testosterona, los niveles de androstenediona, el índice de andrógenos libres, los niveles de LH, la relación LH/FSH y los niveles de hormona anti-Mülleriana (Zhou et al., 2016). Las ratas Wistar Hembras tratadas con matricaria chamomilla L. mostraron una disminución de los quistes en el tejido ovárico y un aumento del número de folículos dominantes (Zangeneh et al., 2010). Cocos nucifera L., recuperó el ciclo estral; redujo los niveles de CT, colesterol de muy baja densidad y TG; y aumentó los niveles de HDL-C (Soumya et al., 2014). Las ratas hembra de SD tratadas con Linum usitatissimum L. mostraron un aumento de los folículos antrales y del cuerpo lúteo, una disminución del número de folículos quísticos y una reducción del diámetro de los folículos antrales (Jelodar et al., 2018). Foeniculum vulgare Mill. glomérulo normal inducido, membrana basal normal y capilares (Sadrefozalayi y Farokhi, 2014)., Zingiber officinale Roscoe redujo los niveles de LH y estrógeno, y aumentó los niveles de FSH y progesterona en ratas hembra neonatales con SD (Atashpour et al., 2017). Ginseng rojo coreano (Panax ginseng C. A. Mey.las ratas hembra con SD tratadas mostraron menos folículos quísticos y expresión de ARNm de NGF en ovarios (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata aumentó la velocidad de infusión de glucosa y redujo los niveles de TC y TG (Mannerås et al., 2010). Los datos se resumen en el cuadro 2.,
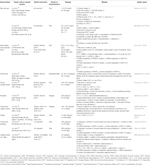
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., La medicina herbal china (CHM) 1 (raíz Astragali raíz Rehmanniae Preparata, Cuscuta me de Lam chino, frutas vive Lucidi, Psoraleae fruta, la raíz de Salviae Miltiorrhizae, y frambuesa Linn) y CHM 2 (Cuscuta me de Lam chino, frutas vive Lucidi, y frambuesa Linn) indujo la recuperación del ciclo estral y la relación LH/FSH, y la reducción de los niveles de androstenediona debe y el índice de andrógenos libres (gu et al., 2015)., La fórmula de Gui Zhu Yi Kun (Gzykf) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia y Luffa cylindrical) redujo las expresiones de ARNm de Beclin 1, cadena ligera 3 y supresor tumoral p53 (Xing et al., 2017). Las ratas hembra con SD tratadas con HemoHIM (Angélica Radix, Cnidii rizoma y Paeonia Radix) mostraron un aumento del número y el tamaño de los cuerpos lúteos y una disminución del nivel de proteína NGF en los ovarios (Kim et al., 2009). Se encontró que Heqi san reduce los niveles de LH y testosterona, y mitiga la resistencia a la insulina(Zhao et al., 2017)., Un nuevo fármaco inmunomodulador a base de hierbas (IMOD) (Rosa canina, Urtica dioica, y Tanacetum vulgare)-ratas Wistar albinas tratadas mostraron menos incidencias de folículos atéticos y quísticos ováricos, y un mayor número de cuerpos lúteos (Rezvanfar et al., 2012). La administración de Kyung-Ok-Ko (KOK) indujo la recuperación del ciclo estral y del grupo de diferenciación (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, proteína quimioatractante de monocitos (MCP)-1, y reducción de la expresión del ARNm de iNOS en ovarios de ratas hembra con SD (Jang et al., 2014; Lee et al., 2016)., Las ratas hembra SD tratadas con Xiao-Yao-San (XYS) (radix bupleuri, Angélica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, jengibre, menta y glicirrizae) mostraron un número reducido de folículos quísticos y una disminución de las células positivas de desoxinucleotidil transferasa terminal dUTP nick end labeling (TUNEL) en los folículos antrales (Sun et al., 2017). Los datos se resumen en el cuadro 3.

Tabla 3 estudios In vitro e in vivo de decocciones de fórmulas a base de hierbas (n = 10).,
Las Acciones de Medicamentos a base de Hierbas para el Tratamiento de SOP

la Tabla 4 las acciones de Los medicamentos a base de hierbas para el tratamiento de SOP.
Los Mecanismos de Acción para el PCOS

en la Tabla 5 Los mecanismos de acción de los medicamentos a base de hierbas en el SOP.,
discusión
nuestra revisión de la literatura publicada hasta el 30 de junio de 2018 resumió los hallazgos de los estudios in vitro e in vivo sobre la eficacia de los medicamentos a base de plantas para el tratamiento del modelo de SOP. Se encontró que un total de cuatro compuestos aislados de hierbas (6 estudios), nueve extractos herbales individuales (11 estudios) y nueve decocciones de fórmulas herbales (10 estudios) tenían efectos inhibitorios sobre el SOP., Según los resultados reportados, las hierbas medicinales normalizaron las hormonas femeninas, disminuyeron las hormonas masculinas, recuperaron el ciclo estral, mejoraron la resistencia a la insulina y mejoraron el metabolismo de los lípidos. Encontramos que la actividad inhibitoria potencial de los medicamentos a base de plantas podría influir en diferentes aspectos del SOP, con los efectos beneficiosos de los medicamentos a base de plantas que surgen principalmente a través de la inflamación, el estrés antioxidante, la inhibición de la autofagia o apoptosis, y la reducción del NGF ovárico.,
los medicamentos a base de hierbas pueden inhibir las condiciones inflamatorias del SOP
estudios recientes han explorado más la etiología y patología del SOP. Los científicos encontraron que en el microambiente de los pacientes con SOP, la inflamación crónica leve es un sello distintivo del síndrome (Nestler, 2000). El SOP ha sido relevante en la inflamación crónica (Benson et al., 2008), y los macrófagos han sido su principal patogénesis (Wu et al., 2004). Los macrófagos ováricos producen citocinas, quimiocinas y factores de crecimiento tanto en el proceso normal como en el inflamatorio del ovario., Los macrófagos pueden orquestar la apoptosis y la remodelación tisular, que están involucradas en la foliculogénesis, la ovulación y la formación del cuerpo lúteo (Benson et al., 2008). Dado el papel crítico de los macrófagos en el SOP (Benson et al., 2008), numerosos estudios han comparado los niveles de citoquinas en suero y en fluidos foliculares en pacientes con SOP. Los niveles de TNF-α e IL-6 en suero y en fluidos foliculares fueron elevados en pacientes con SOP no obesos/no diabéticos tratados con gonadotrofinas (Amato et al., 2003)., La proteína inflamatoria de macrófagos-1α y MCP-1 se incrementaron en pacientes con SOP y se asociaron con adiposidad (Glintborg et al., 2009). la iNOS, la ciclooxigenasa-2 (COX-2) y la actividad del factor de crecimiento transformador (TGF)-β aumentaron en los ovarios de pacientes con SOP (Elia et al., 2006; Hatzirodos et al., 2011), y la actividad de inos y COX-2 se previnieron mediante la administración de metformina (Elia et al., 2006). Estos resultados sugieren que el sistema inmune es relevante para la patogénesis del SOP., Por lo tanto, los nuevos remedios dirigidos a este proceso inflamatorio pueden ser una alternativa terapéutica al tratamiento actual.
en esta revisión, los iridoides inhibieron significativamente la expresión de IL-1β, IL-6, IL-10 e iNOS, inhibiendo así las condiciones inflamatorias (Zuo et al., 2017). La quercetina también redujo significativamente los niveles de IL-1β, IL-6 y TNF-α, y disminuyó la translocación nuclear del factor nuclear kappa B (NF-kB) en un modelo de rata de SOP resistente a la insulina (Wang et al., 2017)., La pre-administración de KOK disminuyó el aumento de la expresión de la molécula de adaptador de unión al calcio ionizado -1 ( + ) macrófagos en la capa de células teca de quistes y el estroma. KOK también aumentó la expresión de mRNA de CD11b y CD3 en el tejido ovárico del SOP. La administración previa de KOK disminuyó significativamente los niveles aumentados de IL-1β, IL-6, IL-8, TNF-α, MCP-1 e iNOS; y aumentó la expresión reducida del ARNm del factor de crecimiento epidérmico y del TGF-β en los ovarios del SOP., Estos resultados demostraron que KOK regula la expresión de mediadores inflamatorios en el modelo PCOS inducido por dehidroepiandrosterona (DHEA) (Jang et al., 2014). Los mediadores inflamatorios también se regularon en el endometrio del útero mediante la administración de KOK, que ha demostrado prevenir la hiperplasia endometrial en modelos de SOP (Lee et al., 2016). También se demostró que el TNF-α en el suero y la prostaglandina E (PGE) en el ovario disminuyeron por los IMODs (Rezvanfar et al., 2012).,
los medicamentos a base de hierbas pueden atenuar el estrés oxidativo en el SOP
las especies reactivas de oxígeno son moléculas de señal importantes en la regulación de las funciones fisiológicas en la reproducción femenina, incluida la esteroidogénesis, la foliculogénesis, la maduración de los ovocitos, la función del cuerpo lúteo y la luteólisis (Agarwal et al., 2005). Además, juegan un papel clave en los procesos patológicos de la reproducción femenina(Agarwal et al., 2003; Agarwal et al., 2008)., El estrés oxidativo es una condición en la que se deteriora el equilibrio entre la capacidad antioxidante del cuerpo y los productos tóxicos derivados del oxígeno y/o el nitrógeno. En consecuencia, los radicales libres no están suficientemente desintoxicados por los antioxidantes celulares. El estrés oxidativo juega un papel importante en la reproducción femenina (Ruder et al., 2008; Ruder et al., 2009; Vakilian et al., 2009), y existe una creciente literatura sobre los efectos del aumento de los marcadores de estrés oxidativo en mujeres infértiles, y sobre su participación en la fisiopatología del SOP (Joo et al., 2010; Mohamadin et al., 2010)., El SOP se caracteriza por inflamación crónica, estrés oxidativo y expresión anormal de microRNA (Zhao et al., 2015; Zuo et al., 2016). Dado que se sabe que la inflamación y el estrés oxidativo están estrechamente relacionados, el estrés oxidativo elevado generalmente resulta de, y conduce a, una condición inflamatoria (Zuo et al., 2016). Es difícil separar la inflamación del estrés oxidativo, y en los últimos años se ha propuesto que la inflamación y el estrés oxidativo constituyen la base principal de la aparición de la enfermedad (Duleba y Dokras, 2012).
en esta revisión, IMODs (Rezvanfar et al.,, 2012) e iridoides (Zuo et al., 2017) mostraron efectos positivos sobre el estrés oxidativo/nitrosativo, ya sea directa o indirectamente, principalmente al reducir los radicales libres e inhibir las citoquinas inflamatorias en ratas SOP. La administración de imod redujo significativamente la peroxidación lipídica (un marcador de estrés oxidativo) y aumentó los niveles de superóxido dismutasa, catalasa y glutatión peroxidasa (marcadores de potencial antioxidante) en el SOP inducido por hiperandrogenismo. Además, los niveles de peroxinitrito (un marcador de estrés nitrosativo), TNF-α y PGE se redujeron significativamente por los IMODs., Además, estos efectos de los imod fueron consistentes con la evidencia histológica, que mostró una mejora significativa en las características microscópicas de la foliculogénesis en comparación con las del grupo control (Rezvanfar et al., 2012). El sistema de señalización NF-kB es conocido como un paradigma dominante para moléculas de transducción de señales específicas, activación génica y proteínas reguladoras en respuesta a la inflamación (Ivanenkov et al., 2011)., Los iridoides atenuaron eficientemente la elevación inducida por lipopolisacáridos de los niveles de fosforilación de IkB, disminuyeron los niveles de expresión de IkB y disminuyeron el NF-kB P65, lo que indica que los iridoides ejercen sus efectos antioxidantes a través de la vía NF-kB (Zuo et al., 2017).
los medicamentos a base de hierbas pueden regular la Apoptosis y/o la autofagia en el SOP
la supervivencia o muerte de las células de la granulosa se reconoce como un factor crítico que afecta el destino de los folículos (Matsuda et al., 2012). La Apoptosis y la autofagia son dos formas de muerte celular programada., La autofagia es el proceso por el cual un autofagosoma, que es una vesícula de doble membrana, transporta material citoplasmático al lisosoma (Mizushima y Komatsu, 2011). Se ha reportado que tanto la apoptosis como la autofagia pueden ser inducidas en las células de la granulosa, y que están involucradas en el control del desarrollo folicular (Choi et al., 2010; Choi et al., 2013). Las células de la Granulosa son reconocidas como actores críticos en el desarrollo del folículo. Producen estradiol, factores de crecimiento similares a la insulina y otras citocinas en el ovario y expresan los receptores de estradiol, LH y FSH (Juengel et al.,, 2006), todos los cuales participan en la regulación del desarrollo folicular. Por lo tanto, cualquier deterioro de las células de la granulosa puede resultar en un desarrollo desordenado de los folículos.
en la última década, se han identificado vías de señalización relacionadas con la autofagia y sus principales reguladores de proteínas. La proteína 1 de la cadena ligera 3 asociada a microtúbulos de rata está asociada con el procesamiento de la membrana del autofagosoma (Kabeya et al., 2000). Beclin-1 también ha demostrado tener un papel crítico en la formación de autofagosomas (Von Hoven et al., 2012)., Además, estudios previos han identificado el supresor tumoral p53 (p53) como un modulador dual de la autofagia en la regulación de la muerte o supervivencia celular (Vousden y Ryan, 2009; Zhang et al., 2010). A bajos niveles de energía, la proteína quinasa activada por adenosina monofosfato (AMPK), que es activada por p53, es capaz de activar el complejo de esclerosis tuberosa 2 y, por lo tanto, inhibir la actividad de la diana mamífera de la rapamicina (mTOR) y aumentar la autofagia (Feng et al., 2007)., En esta revisión, p53, que es activado por GZYKF en el núcleo, a su vez activó AMPK y sestrin, actuando como una retroalimentación en la inhibición de mTOR, activando así la autofagia. La autofagia también es modulada por las vías de señalización de la fosfoinositida 3-quinasa/proteína quinasa B (PI3K/Akt) (Pyo et al., 2012). En esta revisión, XYS alivió la reducción de la fosforilación del polipéptido I de la quinasa S6 de la proteína ribosómica y Akt, así como el aumento de la conversión de la cadena ligera 3-I de la proteína asociada a microtúbulos a la cadena ligera 3-II de la proteína asociada a microtúbulos tanto in vivo como in vitro (Sun et al., 2017).,
la endometria de la mayoría de las pacientes con SOP es gruesa y presenta hiperplasia simple, complicada o atípica o transformación maligna que puede estar correlacionada con la apoptosis de las células endometriales (Villavicencio et al., 2007). El hiperandrogenismo inducido por DHEA se asocia con un mayor número de células apoptóticas en la endometria, y la metformina (un agente insulinomimético o sensibilizante de insulina) es capaz de reducir el aumento del número de células apoptóticas (Elia et al., 2009). En esta revisión, la muerte celular apoptótica fue evaluada por tinción de TUNEL., Las células apoptóticas rara vez se detectaron por tinción de TUNEL en el tejido uterino del grupo simulado o del grupo de Kok solo. Sin embargo, el número de células TUNEL-positivas se incrementó en la endometria del grupo DHEA. El aumento del número de células apoptóticas se redujo significativamente después de la administración de KOK. Estos resultados indican que la administración previa de KOK inhibió la malformación endometrial inducida por DHEA al reducir la apoptosis endometrial (Lee et al., 2016).,
los medicamentos a base de hierbas pueden reducir el nivel de NGF en el SOP
estudios previos han demostrado que el SOP está asociado con una activación anormal del sistema nervioso simpático, lo que resulta en un aumento de los nervios catecolaminérgicos (Semenova, 1969), un deterioro del metabolismo de la norepinefrina (Garcia-Rudaz et al., 1998), y el aumento de la actividad de los nervios simpáticos a través del nervio ovárico superior (Lara et al., 1993)., El desarrollo y la función de la inervación simpática ovárica dependen del ovario para la producción de NGF, una neurotrofina derivada de la diana necesaria para el desarrollo del sistema simpático periférico (Levi-Montalcini, 1987). La familia de las neurotrofinas, implica el receptor NGF y el mRNA NGF en la ovulación y en la fisiopatología del SOP (Lara et al., 2000; Stener-Victorin et al., 2003). En los ovarios de ratas, el NGF se sintetiza principalmente en las células de la pared folicular (Dissen et al.,, 1996), y en el SOP, la activación del NGF puede ser un factor involucrado en la mejora de la salida de norepinefrina a la glándula, que es inducida por el valerato de estradiol (EV) (Lara et al., 2000) el SOP exhibe una alta densidad de fibras nerviosas intraovarianas que se asocia con hiperrespuesta simpática (Stener-Victorin et al., 2003).
en esta revisión, La administración de las fórmulas herbales Changbudodam-Tang y Yongdamsagan-Tang disminuyó significativamente el NGF elevado en los ovarios con poco efecto en el tejido cerebral (Lee et al., 2003)., HemoHIM también normalizó el NGF, redujo el alto número de folículos antrales y aumentó el número de cuerpos lúteos en el SOP. Estos resultados son consistentes con los de estudios previos sobre los efectos beneficiosos del HemoHIM en la prevención y tratamiento del SOP (Pak et al., 2009). Además, la administración de extracto de ginseng rojo coreano (Pak et al., 2009; Jung et al., 2011) y el ginseng rojo coreano saponinas totales (Pak et al., 2005) disminuyó significativamente la expresión de la proteína NGF y el ARNm NGF, en comparación con los de los ovarios tratados con EV.,
Este estudio revisó la evidencia de los medicamentos a base de plantas que se pueden utilizar para tratar el SOP y sus síntomas asociados, y los hallazgos tienen la intención de aumentar la comprensión de los médicos sobre los mecanismos de acción de los medicamentos a base de plantas en el tratamiento del SOP. La principal limitación de nuestro estudio es la heterogeneidad de las intervenciones. Además, nuestro estudio no realizó una evaluación de la calidad de cada estudio ni una síntesis cuantitativa de los resultados. Se justifican otros estudios que incluyan la evaluación metodológica de la calidad y la síntesis cuantitativa de los resultados.,
conclusión
en esta revisión, un total de 27 estudios con 22 medicamentos a base de hierbas mostraron efectos beneficiosos sobre el SOP. Las intervenciones herbales en los 27 estudios comprendieron cuatro compuestos aislados de hierbas (6 estudios), nueve extractos herbales individuales (11 estudios) y nueve decocciones de fórmulas herbales (10 estudios). Se demostró que los medicamentos a base de hierbas normalizan las hormonas femeninas, disminuyen las hormonas masculinas, recuperan el ciclo estral, mejoran la resistencia a la insulina y mejoran el metabolismo de los lípidos en el SOP., Los mecanismos subyacentes a los efectos beneficiosos de los medicamentos a base de plantas sobre el SOP están asociados con antiinflamatorios, estrés antioxidante, inhibición de la autofagia y/o apoptosis y reducción del NGF ovárico. Las hierbas medicinales pueden considerarse como recursos prometedores en el desarrollo de agentes terapéuticos eficaces para el SOP.
contribuciones de los autores
I-HC y KP diseñaron el estudio. C-YK y KP buscaron los artículos y analizaron los datos. KP escribió el manuscrito y I-HC lo revisó. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.,
Funding
This work was supported by National Research Foundation of Korea (NRF) grant funded by the Korea government (MSIP) (No.NRF-2017r1c1b1006387) y la sociedad coreana de Ginseng (2019).
conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE / ASRM-Sponsored PCOS Consensus Workshop Group (2004). Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertility Sterility 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Full Text | Google Scholar
Semenova, I. (1969). Inervación adrenérgica de ovarios en el síndrome de Stein-Leventhal. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar