la Thermodynamique est une branche de la physicswhich traite de l’énergie et de travail d’un système.La thermodynamique ne traite que de la réponse à grande échelle d’un système que nous pouvons observer et mesurer dans des expériences. Les interactions gazeuses à petite échelle sontdécrit par la théorie cinétique des gaz.Il y a trois principauxles lois de la thermodynamique qui sont décrites sur des diapositives séparées., Chaque loi conduit à la définition des propriétés thermodynamiques qui nous aident à comprendre et à prédire le fonctionnement d’un système physique. Nous présenterons quelques exemples simples de ces lois etpropriétés pour une variété de systèmes physiques, bien que nous soyons plus intéressés par la thermodynamique des systèmes de propulsion et des flux à haute vitesse.Heureusement, bon nombre des exemples classiques de thermodynamique impliquent la dynamique des gaz.,
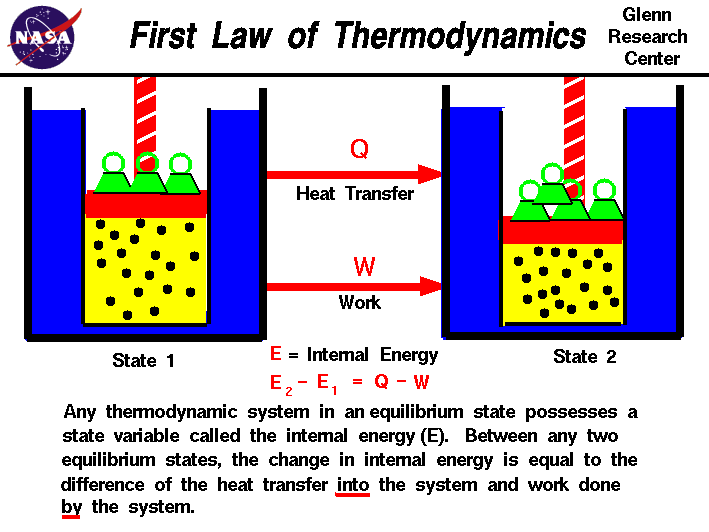
dans nos observations du travail effectué sur,ou par un gaz, nous avons constaté que la quantité de travail dépend non seulementsur les états initial et final du gazmais aussi sur le processus, ou chemin qui produit l’état final.De même, la quantité de chaleur transférée dans ou à partir d’un gaz dépend également des états initial et final et du processus qui produit l’état final., De nombreuses observations de realgases ont montré que la différence du flux de chaleur dans le Gazet le travail effectué par le gaz ne dépend que des états initiaux et finaux du gaz et ne dépend pas du processus ou du chemin qui produit l’état final. Cela suggère l’existence d’une variable supplémentaire, appelée l’énergie interne du gaz,qui ne dépend que de l’état du gaz et non d’aucun processus.L’énergie interne est une variable d’état, tout comme la température oula pression., La première loi de la thermodynamique définit l’internel’énergie (E) comme égale à la différence du transfert de chaleur (Q) dans un système et du travail (W) effectué par le système.
E2 – E1 = Q – W
Nous l’avons souligné thewords « dans » et « par » dans la définition. Chaleur retirée d’un systèmedevrait être attribué un signe négatif dans l’équation. De même, workdone sur le système se voit attribuer un signe négatif.,
l’énergie interne n’est qu’une forme d’énergie comme l’énergie potentielle d’un objet à une certaine hauteur au-dessus de la terre, ou l’énergie cinétique d’un objet en mouvement. De la même manière que l’énergie potentielle peut être convertie en énergie cinétique tout en conservant l’énergie totale du système, l’énergie interne d’un système thermodynamique peut être convertie en énergie cinétique ou potentielle. Comme potentialenergy, l’énergie interne peut être stockée dans le système.Notez cependant que la chaleur etle travail ne peut pas être stocké ou conservé indépendamment car ils dépendent du processus., La première loi de la thermodynamique permet à de nombreuxétats possibles d’un système d’exister, mais seuls certains états sont trouvés exister dans la nature. La deuxième loi de la thermodynamique aide à expliquer cette observation.
Si un système est complètement isolé de l’environnement extérieur, il est possible d’avoir un changement d’état dans lequel aucune chaleur n’est transférée dans le système. Les scientifiques se réfèrent à un processus qui n’implique pas de transfert de chaleur comme un processus adiabatique.,La mise en œuvre de la première loi de la thermodynamique pour les gaz introduit un autrevariable d’état utile appelée enthalpiequi est décrit sur une page séparée.
Activités:
Visites Guidées
-
 Thermodynamique:
Thermodynamique: 
Navigation ..
![]()
![]()
![]()
Guide du Débutant en Page d’Accueil