compétences à développer
- comprendre pourquoi Lavoisier est parfois appelé « le père de la chimie moderne »
- distinguer la précision de la précision
alors ce qui est arrivé à transformer l’alchimie, qui était comme potion magique brassage dans Harry Potter, de chimie? Il était de mesure. Mesure minutieuse et minutieuse des quantités, telles que les masses, les volumes, les densités, les températures, les pressions.
un des premiers héros de la mesure était Antoine Lavoisier., Il a été l’un des premiers vrais chimique scientifiques. Il a mené des expériences minutieuses et n’a essayé de tirer aucune conclusion sauf celles requises par ses données. Il a dit que les faits, les idées et les mots devraient être aussi étroitement liés que possible: vous ne pouvez pas améliorer votre langue sans améliorer votre pensée, et vous ne pouvez pas améliorer votre pensée sans améliorer votre langue. Il a donc été le pionnier d’une nomenclature chimique systématique qui est essentiellement ce que nous utilisons aujourd’hui., Remarquablement, si vous lisez son texte, écrit en 1789, destiné à introduire la chimie aux débutants, une grande partie est toujours parfaitement compréhensible et même correcte selon les normes modernes.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier décrit tout d’abord les états de la matière: gaz, liquides et solides. Il souligne que lorsqu’un matériau solide est chauffé, il a tendance à se dilater, devenant d’abord un liquide, qui prend un volume constant, mais peut être versé, contrairement à un solide., Plus de chauffage, et il devient un gaz, qu’il décrit comme élastique car il va se dilater ou se comprimer à différents volumes en fonction de la pression. Contrairement aux philosophes grecs, il a compris qu’il s’agissait d’un changement physique, pas d’un changement chimique, et il a une bonne intuition à l’échelle submicroscopique de ce qui se passe: les particules du matériau ne changent pas, elles s’éloignent simplement.,
il brûlait du soufre, du phosphore et du charbon de bois (carbone) et faisait des observations minutieuses, souvent en utilisant le bocal à cloche sur un seau de mercure, comme le montre le dessin de son livre, Figure 1. Il s’agit d’un exemple de changement chimique ou de réaction chimique, dans lequel les produits chimiques réactifs se transforment en différents produits chimiques. Si vous allumez le soufre dans le plat étiqueté D Sous la cloche d’air, il brûle jusqu’à ce qu’il s’éteigne en laissant un peu de soufre supplémentaire. L’air restant dans le pot n’est plus bon pour respirer. Si vous mettez une souris dans le pot, elle mourra, tout comme la flamme., Cela démontre le concept de réactif limitant. La réaction ou la combustion s’est arrêtée lorsqu’elle a manqué d’oxygène, laissant principalement de l’azote (et quelques traces d’autres gaz) dans le pot. Priestley, un autre scientifique, lui a montré comment préparer du gaz oxygène pur, et il l’a utilisé pour faire de nombreuses expériences de combustion.
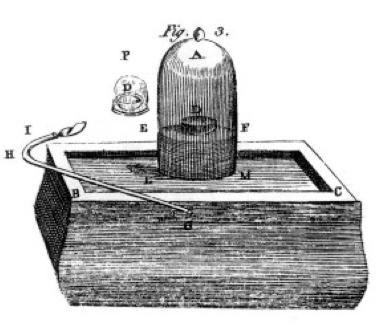
Lavoisier était obsédé par la mesure., Il a développé des appareils élaborés pour tout mesurer. Il brûlerait du phosphore, comme le montre la Figure 1, et observerait la formation d’un produit floconneux blanc. Le phosphore (le réactif dans ce cas) n’était pas soluble dans l’eau, mais le produit l’était, alors il a recueilli le produit très soigneusement, le séparant du phosphore qui n’a pas réagi en le lavant avec de l’eau. Après séchage, il pouvait mesurer la quantité de phosphore qui avait brûlé, la quantité d’oxygène qui avait été consommée (car il connaissait la densité de l’oxygène gazeux) et la quantité de produit qui s’était formée., Il a constaté que la masse de produit était la somme des masses de réactif consommées, dans chaque expérience. C’est la loi de conservation de la masse (que certains alchimistes et chimistes antérieurs avaient également utilisée). Il a également observé que le phosphore n’a pas de goût, mais le produit, qu’il a appelé l’acide phosphorique, est aigre. Il savait de ces expériences que dans de nombreux cas, les éléments ne se combinent que dans certaines proportions, et aussi que l’oxygène peut se combiner avec le soufre, le phosphore, etc. dans deux rapports différents., Il nous a donné la terminologie que nous utilisons encore aujourd’hui: l’acide sulfurique est composé de soufre et d’oxygène, acide sulfureux est composé de soufre et moins d’oxygène. -unités signifie moins d’oxygène; -ic signifie plus d’oxygène. Voir la page nomenclature pour plus de détails.
Lavoisier a porté une attention particulière à la précision et à la précision. Par exemple, dans l’expérience que nous venons de décrire, il a mesuré le volume de gaz dans le bocal à cloche, avant et après la réaction, mais a noté qu’après la réaction, vous devez attendre que la température revienne à ce qu’elle était lorsque vous avez mesuré à l’origine., Si le gaz est chaud lorsque vous mesurez son volume après la réaction, il se sera dilaté et votre densité standard ne s’appliquera pas. Cela introduirait une erreur systématique dans les mesures: chaque fois que vous effectuez l’expérience, vous penserez qu’il reste plus de gaz qu’il n’y en a réellement, et votre mesure ne sera pas précise. Si le résultat moyen de votre expérience est proche de la valeur correcte, il est exact. Cependant, si votre expérience donne des nombres très différents à chaque fois, même si la moyenne est correcte et que l’expérience est précise, elle n’est pas précise., La précision est la différence entre la réunion « vers 2 heures » et la réunion « à 3 minutes et 27 secondes avant 14 heures. »La précision est la précision que vous êtes, la quantité de détails que vous utilisez. Lavoisier a également contribué au développement du système d’unités (kg, L, m) actuellement utilisé en Corée et dans de nombreux autres pays.

dans l’ensemble, bien qu’il n’ait pas fait beaucoup d’expériences originales que personne d’autre n’avait faites auparavant, il a fait ses expériences très soigneusement, afin qu’elles soient aussi précises et précises que possible, puis il y a pensé clairement et créé des mots pour décrire les produits chimiques et les idées qui ont contribué à rendre tout plus clair., Si vous lisez un manuel de chimie écrit avant Lavoiser, vous serez très confus parce que les noms des produits chimiques seraient basés sur l’histoire (et sonneraient comme ils venaient de Harry Potter), plutôt que d’être basé sur ce que sont les produits chimiques. Si vous lisez un texte de chimie écrit après Lavoiser, vous reconnaîtrez la langue comme similaire à ce que nous utilisons aujourd’hui.
Résumé
Précision décrit comment fermer une valeur mesurée à la valeur réelle. La précision décrit dans quelle mesure un groupe de valeurs mesurées s’accorde les unes avec les autres., La loi de conservation de la masse stipule que la matière ne peut ni être créée ni détruite par un processus chimique ou physique. Il en résulte que la somme des masses de réactif consommées dans toute expérience est égale à la masse de produit. Les changements chimiques impliquent la modification de l’identité chimique d’une substance de telle sorte que de nouvelles substances se forment. Les changements physiques impliquent de modifier une substance sans changer son identité chimique. La Combustion et la rouille sont deux exemples de processus chimiques tandis que l’ébullition et la fusion sont des exemples de processus physiques., Les réactions chimiques impliquent de transformer des réactifs, des produits chimiques qui sont consommés dans le processus de changement chimique, en Produits, Produits chimiques produits par le processus de changement chimique qui ont une composition différente des réactifs. Un réactif limitant détermine, ou limite, la quantité de produit qui peut être produite à partir d’une réaction chimique.
Lien externe
- CrashCourse la Chimie: La Loi Fondamentale (11 min)
les Contributeurs et les Attributions
-
Emily V Eames (City College de San Francisco)