Introduction
le syndrome des ovaires polykystiques (SOPK) est l’un des troubles les plus courants de l’endocrinologie chez les femmes en âge de procréer. Le SOPK est diagnostiqué en confirmant la présence de deux des éléments suivants: oligo – et/ou anovulation, hyperandrogénie clinique et/ou biochimique et caractéristiques échographiques des ovaires polykystiques, à l’exclusion d’autres étiologies (Fr Et Tarlatzis, 2004)., Les taux de prévalence du SOPK dépendent des critères de diagnostic utilisés, mais ils peuvent atteindre 18% en utilisant les critères de diagnostic de Rotterdam (Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group, 2004). L’hyperandrogénie se retrouve chez 60 à 80% des femmes atteintes du SOPK (Azziz et al., 2006). Les principales caractéristiques cliniques ou biochimiques de l’hyperandrogénie sont l’acné, l’hirsutisme, l’alopécie et la dermatite séborrhéique; des niveaux élevés de testostérone, d’androstènedione et de sulfate de déhydroépiandrostérone; et une diminution des niveaux de globuline de liaison aux hormones sexuelles (SHBG)., Le syndrome présente non seulement des manifestations reproductives, mais a également des implications métaboliques, notamment la résistance à l’insuline, la dyslipidémie, l’obésité, le diabète de type 2 et l’inflammation systémique (Deugarte et al., 2005; Sartor et Dickey, 2005; Escobar-Morreale et coll., 2011).
bien que le traitement de première intention pour l’induction de l’ovulation chez les femmes atteintes de SOPK soit l’administration de citrate de clomiphène, on pense que les effets anti-œstrogènes du citrate de clomiphène sur l’endomètre et la glaire cervicale entraînent un faible taux de conception de 20% (Gonen et Casper, 1990)., Le citrate de clomifène est également associé à un certain nombre d’effets secondaires, notamment des bouffées de chaleur, une gêne mammaire, une distension abdominale, des nausées, des vomissements, de la nervosité, des maux de tête, une perte de cheveux et une vision perturbée (Legro et al., 2007a). Des études récentes ont étudié le rôle de la metformine en tant qu’agent sensibilisant à l’insuline, et bien que son utilisation augmente, la compréhension de son mécanisme est incomplète (Legro et al., 2007b)., De plus, il peut provoquer le développement de follicules multiples, ainsi qu’un risque d’hyperstimulation ovarienne, de grossesses multiples et de malformations congénitales telles que des anomalies du tube neural, conduisant ainsi à des résultats de traitement potentiellement insatisfaisants.
puisque le SOPK est défini comme un trouble métabolique-endocrinien multifactoriel (Laven et al., 2002), le mode de vie et l’alimentation, et le régime méditerranéen en particulier, jouent un rôle pertinent, parallèlement au traitement pharmacologique (Barrea et al., 2019)., Des études récentes ont suggéré que les traitements complémentaires et alternatifs, y compris les médicaments à base de plantes et l’acupuncture, peuvent atténuer les symptômes du SOPK, mais les preuves de leur efficacité et de leur innocuité sont insuffisantes. Par conséquent, de nouvelles stratégies de traitement intégrant des thérapies complémentaires et Alternatives doivent être étudiées pour optimiser le traitement du SOPK. Dans cette étude, nous avons examiné les données sur les effets et les mécanismes sous-jacents des médicaments à base de plantes utilisés dans le traitement du modèle SOPK dans des études de laboratoire.,
méthodes
Les Articles publiés en anglais jusqu’au 30 juin 2018 ont été recherchés dans Medline (via PubMed) et EMBASE (via Elsevier). Les termes de recherche étaient une combinaison de termes de rubrique médicale (MeSH) et de leurs synonymes. Les termes de recherche utilisés étaient les suivants: et .
Les critères d’inclusion de notre examen a porté sur les éléments suivants:
1. Études In vitro et in vivo qui ont évalué les effets potentiels des médicaments à base de plantes sur le modèle SOPK
2., Recherche sur les composés isolés à partir d’herbes, d’extraits de plantes individuels ou de décoctions de formule à base de plantes
3. Des Articles écrits en anglais
Les critères d’exclusion étaient les suivants:
1. Essais cliniques de médicaments à base de plantes pour le SOPK
2. Articles de synthèse
3., Articles qui ne décrivaient pas les composants de la phytothérapie; cependant, cela a été autorisé dans le cas des phytothérapie brevetées
parmi les études récupérées, après avoir supprimé les doublons, les titres et les résumés ont été examinés pour trouver des articles potentiellement pertinents. Ensuite, les textes complets des articles sélectionnés ont été examinés pour confirmer qu’ils répondaient à nos critères d’inclusion.,
nous avons extrait des données concernant l’intervention à base de plantes; l’utilisation de cellules cibles (ou de modèles animaux); la méthode d’extraction à base de plantes: voie d’administration; la posologie et les périodes; et les résultats des composés isolés à partir d’herbes, d’extraits de plantes individuels et de décoctions de formule à base de plantes. Sur la base de ces données, nous avons résumé les actions et les mécanismes sous-jacents aux effets bénéfiques des médicaments à base de plantes sur le modèle SOPK.
résultats
caractéristiques de l’étude
dans la présente revue, nous avons inclus un total de 27 études impliquant 22 médicaments à base de plantes qui ont rapporté leur efficacité sur le modèle SOPK., Nous avons identifié deux études in vitro, 22 études in vivo, et trois études in vitro et in vivo. Les interventions à base de plantes dans les études 27 comprenaient quatre composés isolés à partir d’herbes (études 6), neuf extraits de plantes individuels (études 11) et neuf décoctions de formule à base de plantes (études 10). Un diagramme du processus de sélection de l’article est illustré à la Figure 1.
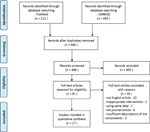
la Figure 1 diagramme de Flux de l’étude du processus de sélection.,
Interventions à base de plantes et leurs résultats en laboratoire
composés isolés des herbes
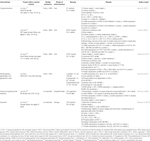
Tableau 1 études In vitro et in vivo de composés isolés des herbes (n=6).
Individu Extraits de plantes
Aloe vera (L.) Burm.F. réduction des taux plasmatiques de cholestérol total (TC), de triglycérides (TG) et de cholestérol lipoprotéique de basse densité (LDL-C); augmentation des taux de cholestérol lipoprotéique de haute densité (HDL-C) (Desai et al.,, 2012); croissance folliculaire normalisée; et récupéré le cycle œstral (Maharjan et al., 2010). Atractylodes macrocephala Koidz. induit la récupération du cycle œstral et la réduction des niveaux de testostérone, des niveaux d’androstènedione, de l’indice d’androgène libre, des niveaux de LH, du rapport LH/FSH et des niveaux d’hormones anti-Müllériennes (Zhou et al., 2016). Les rats Wistar femelles traités par Matricaria chamomilla l. ont montré une diminution des kystes dans le tissu ovarien et un nombre accru de follicules dominants (Zangeneh et al., 2010). Cocos nucifera L., récupération du cycle œstral; réduction des niveaux de TC, de cholestérol à très faible densité et de TG; et augmentation des niveaux de HDL-C (Soumya et al., 2014). Les rats SD femelles traités par Linum usitatissimum L. ont montré une augmentation des follicules antraux et du corps jaune, une diminution du nombre de follicules kystiques et une réduction du diamètre des follicules antraux (Jelodar et al., 2018). Foeniculum vulgare Moulin. glomérule normal induit, membrane basale normale et capillaires (Sadrefozalayi et Farokhi, 2014)., Zingiber officinale Roscoe a abaissé les niveaux de LH et d’œstrogène, et a augmenté les niveaux de FSH et de progestérone chez les rats SD femelles néonatales (Atashpour et al., 2017). Ginseng rouge coréen (Panax ginseng C. A. Mey.)- les rats femelles SD traités ont montré moins de follicules kystiques et d’expression de L’ARNm du NGF dans les ovaires (Pak et al., 2009; Jung et coll., 2011). Labisia pumila var. alata a amélioré le taux de perfusion de glucose et réduit les niveaux de TC et de TG (Mannerås et al., 2010). Les données sont résumées dans le tableau 2.,
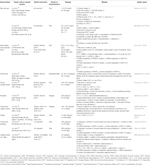
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Phytothérapie chinoise (CHM) 1 (racine Astragali racine Rehmanniae Preparata, Cuscuta me de Lam chinois, Fruit Lives Lucidi, Fruit Psoraleae, la racine de Salviae Miltiorrhizae et framboise Linn) et CHM 2 (Cuscuta me de Lam chinois, Fruit Lives Lucidi et framboise Linn) a induit la récupération du cycle œstral et du rapport LH/FSH, et la réduction de l’androstènedione devrait niveaux et, 2015)., La formule de gui Zhu Yi Kun (gzykf) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia et luffa cylindrical) a réduit les expressions de l’ARNm de Beclin 1, de la chaîne légère 3 et du suppresseur de tumeur p53 (Xing et al., 2017). Les rats femelles traités par HemoHIM (Angelica Radix, Cnidii Rhizoma et Paeonia Radix) ont montré une augmentation du nombre et de la taille des corps jaunes et une diminution du taux de protéine NGF dans les ovaires (Kim et al., 2009). Heqi san a été trouvé pour réduire les niveaux de LH et de testostérone, et pour atténuer la résistance à l’insuline (Zhao et al., 2017)., Un nouveau médicament immunomodulateur à base de plantes (IMOD) (Rosa canina, Urtica dioica et Tanacetum vulgare)-les rats Wistar albinos femelles traités ont montré moins d’incidence de follicules atrétiques et kystiques ovariens, et un plus grand nombre de corps lutea (Rezvanfar et al., 2012). L’administration de Kyung-Ok-Ko (KOK) a induit la récupération du cycle œstral et du cluster de différenciation (CD)11B, CD3, IL-1β, IL-6, TNF-α, IL-8, la protéine chimioattractant monocytaire (MCP)-1 et la réduction de l’expression de l’ARNm iNOS dans les ovaires des rats SD femelles (Jang et al., 2014; Lee et coll., 2016)., Les rats SD femelles traités avec Xiao-Yao-San (XYS) (radix bupleuri, angelica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, gingembre, menthe et glycyrrhizae) ont montré un nombre réduit de follicules kystiques et une diminution de la désoxynucléotidyl transférase terminale dUTP nick end labelling (TUNEL) cellules positives dans les follicules antraux (Sun et al., 2017). Les données sont résumées dans le tableau 3.

Tableau 3 études In vitro et in vivo de décoctions de formule à base de plantes (n=10).,
Les Actions de Médicaments à base de plantes pour le Traitement du SOPK

le Tableau 4 Les actions de médicaments à base de plantes pour le traitement du SOPK.
Les Mécanismes d’Action pour le SOPK

le Tableau 5 Les mécanismes d’action des médicaments à base de plantes sur SOPK.,
Discussion
notre revue de la littérature publiée jusqu’au 30 juin 2018 A résumé les résultats des études in vitro et in vivo sur l’efficacité des médicaments à base de plantes pour le traitement du modèle SOPK. Un total de quatre composés isolés à partir d’herbes (études 6), neuf extraits de plantes individuels (études 11) et neuf décoctions de formule à base de plantes (études 10) ont eu des effets inhibiteurs sur le SOPK., Selon les résultats rapportés, les médicaments à base de plantes ont normalisé les hormones féminines, diminué les hormones mâles, récupéré le cycle œstral, amélioré la résistance à l’insuline et amélioré le métabolisme des lipides. Nous avons constaté que l’activité inhibitrice potentielle des médicaments à base de plantes pourrait influencer différents aspects du SOPK, les effets bénéfiques des médicaments à base de plantes se produisant principalement par l’anti-inflammation, le stress anti-oxydatif, l’inhibition de l’autophagie ou de l’apoptose et la réduction du NGF ovarien.,
les médicaments à base de plantes peuvent inhiber les Conditions inflammatoires du SOPK
des études récentes ont exploré l’étiologie et la pathologie du SOPK. Les scientifiques ont constaté que dans le microenvironnement des patients atteints de SOPK, une inflammation chronique légère est une caractéristique du syndrome (Nestler, 2000). Le SOPK a été pertinent dans l’inflammation chronique (Benson et al., 2008), et les macrophages ont été sa pathogenèse majeure (Wu et al., 2004). Les macrophages ovariens produisent des cytokines, des chimiokines et des facteurs de croissance dans les processus normaux et inflammatoires de l’ovaire., Les macrophages peuvent orchestrer l’apoptose et le remodelage tissulaire, qui sont impliqués dans la folliculogenèse, l’ovulation et la formation du corps jaune (Benson et al., 2008). Compte tenu du rôle critique des macrophages dans le SOPK (Benson et al., 2008), de nombreuses études ont comparé les taux de cytokines dans le sérum et dans les fluides folliculaires chez les patients atteints de SOPK. Les taux de TNF-α et D’IL-6 dans le sérum et dans les liquides folliculaires ont été élevés chez les patients non obèses/non diabétiques atteints du SOPK traités par des gonadotrophines (Amato et al., 2003)., Les protéines inflammatoires macrophages-1α et MCP-1 ont été augmentées chez les patients atteints de SOPK et associées à une adiposité (Glintborg et al., 2009). l’iNOS, la cyclooxygénase-2 (COX-2) et l’activité du facteur de croissance transformant (TGF)-β ont été augmentés dans les ovaires des patients atteints de SOPK (Elia et al., 2006; Hatzirodos et coll., 2011), et l’activité iNOS et COX-2 ont été évitées par l’administration de metformine (Elia et al., 2006). Ces résultats suggèrent que le système immunitaire est pertinent pour la pathogenèse du SOPK., Par conséquent, de nouveaux remèdes ciblant ce processus inflammatoire peuvent être une alternative thérapeutique au traitement actuel.
dans cette revue, les iridoïdes ont inhibé de manière significative l’expression de L’IL-1β, de l’il-6, de l’il-10 et de l’iNOS, inhibant ainsi les conditions inflammatoires (Zuo et al., 2017). La quercétine a également réduit de manière significative les niveaux D’IL-1β, D’IL-6 et de TNF-α, et a diminué la translocation nucléaire du facteur nucléaire kappa B (NF-kB) dans un modèle de rat SOPK résistant à l’insuline (Wang et al., 2017)., La pré-administration de KOK a diminué l’expression accrue des macrophages ionisés de la molécule -1 (+) adaptateur de liaison au calcium dans la couche de cellules de la thèque des kystes et du stroma. KOK a également augmenté l’expression de L’ARNm de CD11b et CD3 dans le tissu ovarien du SOPK. La pré-administration de KOK a significativement diminué les niveaux accrus d’IL-1β, D’IL-6, D’IL-8, de TNF-α, de MCP-1 et d’iNOS; et a augmenté l’expression réduite de l’ARNm du facteur de croissance épidermique et du TGF-β dans les ovaires du SOPK., Ces résultats ont démontré que KOK régule l’expression des médiateurs inflammatoires dans le modèle SOPK induit par la déhydroépiandrostérone (DHEA) (Jang et al., 2014). Les médiateurs inflammatoires ont également été régulés dans l’endomètre de l’utérus par l’administration de KOK, ce qui a été démontré pour prévenir l’hyperplasie de l’endomètre dans les modèles SOPK (Lee et al., 2016). Il a également été montré que le TNF-α dans le sérum et la prostaglandine E (PGE) dans l’ovaire étaient diminués par les IMODs (Rezvanfar et al., 2012).,
les plantes médicinales peuvent atténuer le Stress oxydatif dans le SOPK
Les espèces réactives de l’oxygène sont des molécules de signal importantes dans la régulation des fonctions physiologiques de la reproduction féminine, y compris la stéroïdogenèse, la folliculogenèse, la maturation ovocytaire, la fonction du corps jaune et la lutéolyse (Agarwal et al., 2005). En outre, ils jouent un rôle clé dans les processus pathologiques de la reproduction féminine (Agarwal et al., 2003; Agarwal et coll., 2008)., Le stress oxydatif est une condition dans laquelle l’équilibre entre la capacité antioxydante du corps et les produits toxiques dérivés de l’oxygène et/ou de l’azote est altéré. Par conséquent, les radicaux libres sont insuffisamment détoxifiés par les antioxydants cellulaires. Le stress oxydatif joue un rôle important dans la reproduction féminine (Ruder et al., 2008; Ruder et coll., 2009; Vakilian et coll., 2009), et il existe de plus en plus de littérature sur les effets de l’augmentation des marqueurs de stress oxydatif chez les femmes infertiles et sur leur implication dans la physiopathologie du SOPK (Joo et al., 2010; Mohamadin et coll., 2010)., Le SOPK est caractérisé par une inflammation chronique, un stress oxydatif et une expression anormale du microARN (Zhao et al., 2015; Zuo et coll., 2016). Comme on sait que l’inflammation et le stress oxydatif sont étroitement liés, un stress oxydatif élevé résulte généralement d’une affection inflammatoire (Zuo et al., 2016). Il est difficile de séparer l’inflammation du stress oxydatif, et il a été proposé ces dernières années que l’inflammation et le stress oxydatif constituent le principal fondement de l’apparition de la maladie (Duleba et Dokras, 2012).
Dans cette revue, IMODs (Rezvanfar et coll.,, 2012) et les iridoïdes (Zuo et coll., 2017) ont montré des effets positifs sur le stress oxydatif/nitrosatif, directement ou indirectement, principalement en réduisant les radicaux libres et en inhibant les cytokines inflammatoires chez les rats SOPK. L’Administration D’IMODs a considérablement réduit la peroxydation lipidique (un marqueur du stress oxydatif) et augmenté les niveaux de superoxyde dismutase, de catalase et de glutathion peroxydase (marqueurs du potentiel antioxydant) dans le SOPK induit par l’hyperandrogénie. De plus, les niveaux de peroxynitrite (marqueur du stress nitrosatif), de TNF-α et D’EGP ont été significativement réduits par les IMODs., De plus, ces effets des IMODs étaient compatibles avec les preuves histologiques, qui montraient une amélioration significative des caractéristiques microscopiques de la folliculogenèse par rapport à celles du groupe témoin (Rezvanfar et al., 2012). Le système de signalisation NF-kB est connu comme un paradigme dominant pour des molécules de transduction de signal spécifiques, l’activation de gènes et les protéines régulatrices en réponse à l’inflammation (Ivanenkov et al., 2011)., Les iridoïdes atténuaient efficacement l’élévation induite par le lipopolysaccharide des niveaux de phosphorylation D’IkB, diminuaient les niveaux D’expression D’IkB et diminuaient le NF-kB P65, indiquant que les iridoïdes exercent leurs effets antioxydants via la voie NF-kB (Zuo et al., 2017).
les médicaments à base de plantes peuvent réguler L’apoptose et/ou L’autophagie dans le SOPK
la survie ou la mort des cellules de la granulosa est reconnue comme un facteur critique ayant un impact sur le devenir des follicules (Matsuda et al., 2012). L’apoptose et l’autophagie sont deux formes de mort cellulaire programmée., L’autophagie est le processus par lequel un autophagosome, qui est une vésicule à double membrane, transporte du matériel cytoplasmique vers le lysosome (Mizushima et Komatsu, 2011). Il a été rapporté que l’apoptose et l’autophagie peuvent être induites dans les cellules de la granulosa et qu’elles sont impliquées dans le contrôle du développement folliculaire (Choi et al., 2010; Choi et coll., 2013). Les cellules de la Granulosa sont reconnues comme des acteurs essentiels du développement des follicules. Ils produisent de l’estradiol, des facteurs de croissance analogues à l’insuline et d’autres cytokines dans l’ovaire et expriment les récepteurs de l’estradiol, de la LH et de la FSH (Juengel et al.,, 2006), qui participent tous à la régulation du développement des follicules. Ainsi, toute altération des cellules de la granulosa peut entraîner un développement désordonné des follicules.
au cours de la dernière décennie, des voies de signalisation liées à l’autophagie et leurs principaux régulateurs protéiques ont été identifiés. La protéine 1 de la chaîne légère 3 associée aux microtubules de rat est associée au traitement de la membrane des autophagosomes (Kabeya et al., 2000). Il a également été démontré que Beclin-1 joue un rôle critique dans la formation des autophagosomes (Von Hoven et al., 2012)., En outre, des études antérieures ont identifié le suppresseur de tumeur p53 (p53) comme un double modulateur de l’autophagie dans la régulation de la mort ou de la survie cellulaire (Vousden et Ryan, 2009; Zhang et al., 2010). À de faibles niveaux d’énergie, la protéine kinase activée par l’adénosine monophosphate (AMPK), qui est activée par p53, est capable d’activer le complexe de sclérose tubéreuse 2 et donc d’inhiber l’activité de la rapamycine cible des mammifères (mTOR) et d’augmenter l’autophagie (Feng et al., 2007)., Dans cette revue, p53, qui est activé par GZYKF dans le noyau, à son tour activé AMPK et sestrin, agissant comme une rétroaction dans l’inhibition mTOR, activant ainsi l’autophagie. L’autophagie est également modulée par les voies de signalisation de la phosphoinositide 3-kinase/protéine kinase B (PI3K/Akt) (Pyo et al., 2012). Dans cette revue, XYS a atténué la réduction de la phosphorylation du polypeptide I et de L’Akt de la protéine S6 kinase ribosomique, ainsi que l’augmentation de la conversion de la chaîne légère 3-I de la protéine associée aux microtubules en chaîne légère 3-II de la protéine associée aux microtubules in vivo et in vitro (Sun et al., 2017).,
l’endomètre de la plupart des patients atteints de SOPK est épais et présente une hyperplasie simple, compliquée ou atypique ou une transformation maligne pouvant être corrélée à l’apoptose des cellules endométriales (Villavicencio et al., 2007). L’hyperandrogénie induite par la DHEA est associée à un plus grand nombre de cellules apoptotiques dans l’endomètre, et la metformine (un agent insulinomimétique ou sensibilisant à l’insuline) est capable de réduire le nombre accru de cellules apoptotiques (Elia et al., 2009). Dans cette revue, la mort cellulaire apoptotique a été évaluée par coloration de TUNEL., Les cellules apoptotiques ont été rarement détectées par coloration de TUNEL dans le tissu utérin du groupe sham ou du groupe Kok seul. Cependant, le nombre de cellules TUNEL-positives a été augmenté dans l’endomètre du groupe DHEA. L’augmentation du nombre de cellules apoptotiques a été significativement réduite après l’administration de KOK. Ces résultats indiquent que la pré-administration de KOK inhibait la malformation endométriale induite par la DHEA en réduisant l’apoptose endométriale (Lee et al., 2016).,
les médicaments à base de plantes peuvent réduire le taux de NGF dans le SOPK
des études Antérieures ont montré que le SOPK est associé à une activation anormale du système nerveux sympathique, entraînant une augmentation des nerfs catécholaminergiques (Semenova, 1969), une altération du métabolisme de la noradrénaline (Garcia-Rudaz et al., 1998), et une activité accrue des nerfs sympathiques via le nerf ovarien supérieur (Lara et al., 1993)., Le développement et la fonction de l’innervation sympathique ovarienne dépendent de l’ovaire pour la production de NGF, une neurotrophine dérivée de la cible nécessaire au développement du système sympathique périphérique (Levi-Montalcini, 1987). La famille des neurotrophines, implique le récepteur NGF et L’ARNm NGF dans l’ovulation et dans la physiopathologie du SOPK (Lara et al., 2000; Stener-Victorin et coll., 2003). Dans les ovaires de rat, le NGF est principalement synthétisé dans les cellules de la paroi folliculaire (Dissen et al.,, 1996), et dans le SOPK, l’activation du NGF peut être un facteur impliqué dans l’amélioration de l’écoulement de la noradrénaline vers la glande, qui est induite par le valérate d’estradiol (EV) (Lara et al., 2000) le SOPK présente une densité élevée de fibres nerveuses intraovariennes associée à une hyperréactivité sympathique (Stener-Victorin et al., 2003).
dans cette revue, L’administration des formules à base de plantes Changbudodam-Tang et Yongdamsagan-Tang a significativement diminué L’élévation du NGF dans les ovaires avec peu d’effet sur le tissu cérébral (Lee et al., 2003)., HemoHIM a également normalisé le NGF, réduit le nombre élevé de follicules antraux et augmenté le nombre de corps jaunes dans le SOPK. Ces résultats concordent avec ceux d’études antérieures sur les effets bénéfiques de L’Hémohim dans la prévention et le traitement du SOPK (Pak et al., 2009). En outre, l’administration d’extrait de ginseng rouge coréen (Pak et al., 2009; Jung et coll., 2011) et le ginseng rouge coréen saponines totales (Pak et al., 2005) ont significativement diminué l’expression de la protéine NGF et de L’ARNm NGF, par rapport à ceux des ovaires traités par EV.,
Cette étude a examiné les données probantes sur les médicaments à base de plantes pouvant être utilisés pour traiter le SOPK et ses symptômes associés, et les résultats visent à améliorer la compréhension par les cliniciens des mécanismes d’action des médicaments à base de plantes dans le traitement du SOPK. La principale limite de notre étude est l’hétérogénéité des interventions. De plus, notre étude n’a pas effectué d’évaluation de la qualité de chaque étude ni de synthèse quantitative des résultats. D’autres études comprenant une évaluation méthodologique de la qualité et une synthèse quantitative des résultats sont justifiées.,
Conclusion
dans cette revue, un total de 27 études impliquant 22 médicaments à base de plantes ont montré des effets bénéfiques sur le SOPK. Les interventions à base de plantes dans les études 27 comprenaient quatre composés isolés à partir d’herbes (études 6), neuf extraits de plantes individuels (études 11) et neuf décoctions de formule à base de plantes (études 10). Il a été démontré que les médicaments à base de plantes normalisent les hormones féminines, diminuent les hormones mâles, rétablissent le cycle œstral, améliorent la résistance à l’insuline et améliorent le métabolisme des lipides dans le SOPK., Les mécanismes sous-jacents aux effets bénéfiques des médicaments à base de plantes sur le SOPK sont associés à l’anti-inflammation, au stress anti-oxydatif, à l’inhibition de l’autophagie et/ou de l’apoptose et à la réduction du NGF ovarien. Les médicaments à base de plantes peuvent être considérés comme des ressources prometteuses dans le développement d’agents thérapeutiques efficaces pour le SOPK.
contributions des auteurs
i-HC et KP ont conçu l’étude. C-YK et KP ont recherché les articles et analysé les données. KP a écrit le manuscrit et I-HC l’a révisé. Tous les auteurs ont contribué à l’article et ont approuvé la version soumise.,
Financement
Ce travail a été soutenu par une subvention de la Fondation Nationale de la recherche de Corée (NRF) financée par le gouvernement coréen (MSIP) (No.NRF-2017R1C1B1006387) et la société coréenne du Ginseng (2019).
conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE/ASRM-Parrainé SOPK Consensus de Groupe de l’Atelier (2004). Consensus révisé de 2003 sur les critères diagnostiques et les risques à long terme pour la santé liés au syndrome des ovaires polykystiques. Fertilité Stérilité 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Texte Intégral | Google Scholar
Semenova, I. (1969). Innervation adrénergique des ovaires dans le syndrome de Stein-Leventhal. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar