un catalyseur est une substance qui accélère une réaction chimique, mais n’est pas consommée par la réaction; par conséquent, un catalyseur peut être récupéré chimiquement inchangé à la fin de la réaction qu’il a été utilisé pour accélérer, ou catalyser.

Discussion
Pour les produits chimiques de réagir, de leurs obligations doivent être réorganisées, parce que les obligations dans les produits sont différents de ceux dans les réactifs.,L’étape la plus lente du réarrangement de la liaison produit ce qu’on appelle un État de transition – une espèce chimique qui n’est ni un réactif ni un produit, mais qui est un intermédiaire entre les deux.
Énergie est nécessaire pour former l’état de transition. Cette énergie est appelée l’énergie d’activation, ou Ea.La lecture du diagramme ci-dessous de gauche à droite montre la progression d’une réaction lorsque les réactifs traversent l’état de transition pour devenir des produits.,
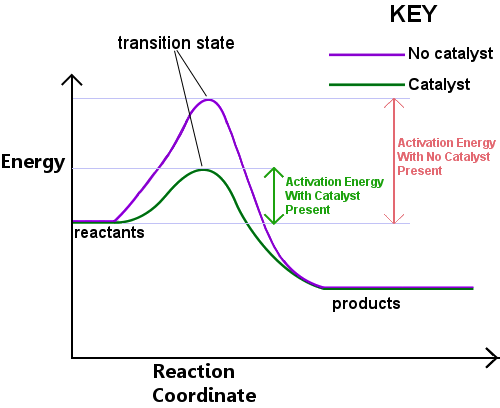
L’énergie d’activation peut être considéré comme un obstacle à une réaction chimique, un obstacle doit être franchi.Si la barrière est haute, peu de molécules ont suffisamment d’énergie cinétique pour entrer en collision, former un État de transition et traverser la barrière.Les réactifs ayant une énergie inférieure à Ea ne peuvent pas passer par l’état de transition pour réagir et devenir des produits.
un catalyseur fonctionne en fournissant une voie différente, avec un Ea inférieur, pour la réaction. Les catalyseurs abaissent la barrière énergétique.,La voie différente permet aux réarrangements de liaison nécessaires pour convertir les réactifs en produits de s’effectuer plus facilement, avec une énergie plus faible input.In tout intervalle de temps donné, la présence d’un catalyseur permet à une plus grande proportion des espèces réactives de capter suffisamment d’énergie pour passer à travers l’état de transition et devenir des produits.
exemple 1: Le procédé Haber
Le procédé Haber, qui sert à fabriquer de l’ammoniac à partir d’hydrogène et d’azote, est catalysé par le fer, qui fournit des sites atomiques sur lesquels les liaisons réactives peuvent se réorganiser plus facilement pour former l’état de transition.,
exemple 2: Enzymes
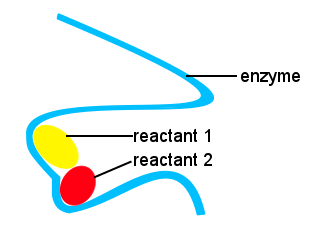
dans notre corps et chez d’autres êtres vivants, les enzymes sont utilisées pour accélérer les réactions biochimiques. Une enzyme est un type de catalyseur.Une vie complexe serait impossible sans enzymes pour permettre aux réactions d’avoir lieu à des vitesses appropriées.Les formes des enzymes ainsi que les emplacements sur l’enzyme qui se lient aux réactifs fournissent une voie de réaction alternative, permettant à des molécules spécifiques de se réunir pour former un État de transition avec une barrière d’énergie d’activation réduite.,
dans le schéma ci-dessous, l’enzyme à longue chaîne fournit des sites permettant aux molécules réactives de se réunir pour former un État de transition avec une faible énergie d’activation.
Les catalyseurs ne peuvent pas déplacer la position d’un équilibre chimique – les réactions avant et arrière sont toutes deux accélérées de sorte que la constante D’équilibre Keq est inchangée.Cependant, en éliminant les produits du mélange réactionnel au fur et à mesure de leur formation, le taux global de formation du produit peut en pratique être augmenté.