un catalizador es una sustancia que acelera una reacción química, pero no es consumida por la reacción; por lo tanto, un catalizador puede recuperarse químicamente sin cambios al final de la reacción que se ha utilizado para acelerar o catalizar.

Discusión
Para los productos químicos a reaccionar, sus bonos se deben cambiar de lugar, porque los bonos de los productos son diferentes de las de los reactivos.,El paso más lento en el reordenamiento del enlace produce lo que se denomina un estado de Transición-una especie química que no es ni un reactivo ni un producto, sino un intermediario entre los dos.
se requiere energía para formar el estado de Transición. Esta energía se llama energía de activación, o Ea.La lectura del siguiente diagrama de izquierda a derecha muestra el progreso de una reacción a medida que los reactivos pasan por el estado de transición para convertirse en productos.,
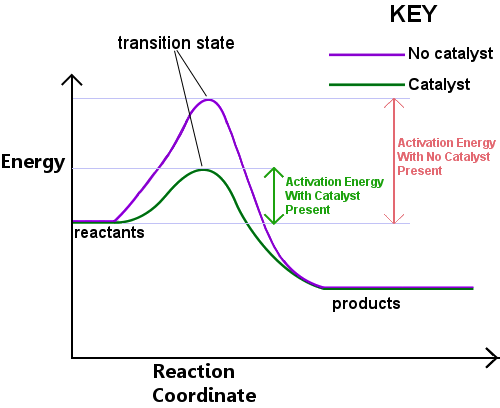
La energía de activación puede ser pensado como una barrera para una reacción química, un obstáculo que debe ser superado.Si la barrera es alta, pocas moléculas tienen suficiente energía cinética para chocar, formar un estado de transición y cruzar la barrera.Los reactivos con energía inferior a Ea no pueden pasar a través del Estado de transición para reaccionar y convertirse en productos.
un catalizador funciona proporcionando una ruta diferente, con Ea inferior, para la reacción. Los catalizadores bajan la barrera de energía.,La diferente ruta permite que los reordenamientos de enlace necesarios para convertir los reactivos en productos se realicen con mayor facilidad, con una menor energía input.In en cualquier intervalo de tiempo dado, la presencia de un catalizador permite que una mayor proporción de las especies reactivas recojan suficiente energía para pasar a través del Estado de transición y convertirse en productos.
Ejemplo 1: el proceso de Haber
el proceso de Haber, que se utiliza para hacer amoníaco a partir de hidrógeno y nitrógeno, es catalizado por hierro, que proporciona sitios atómicos en los que los enlaces reactivos pueden reorganizarse más fácilmente para formar el estado de Transición.,
Ejemplo 2: enzimas
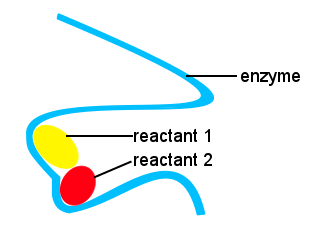
en nuestros cuerpos, y en otros seres vivos, las enzimas se utilizan para acelerar las reacciones bioquímicas. Una enzima es un tipo de catalizador.La vida compleja sería imposible sin enzimas que permitan que las reacciones tengan lugar a velocidades adecuadas.Las formas de las enzimas junto con las ubicaciones en la enzima que se unen a los reactivos proporcionan una vía de reacción alternativa, permitiendo que moléculas específicas se unan para formar un estado de transición con una barrera de energía de activación reducida.,
en el siguiente esquema, la enzima de cadena larga proporciona sitios para que las moléculas de reactivos se unan para formar un estado de transición con una baja energía de activación.
los catalizadores no pueden cambiar la posición de un equilibrio químico: las reacciones hacia adelante y hacia atrás se aceleran para que la constante de equilibrio Keq no cambie.Sin embargo, al eliminar los productos de la mezcla de reacción a medida que se forman, la tasa general de formación del producto puede en la práctica incrementarse.