färdigheter att utveckla
- förstå varför Lavoisier ibland kallas ”fadern till Modern kemi”
- skilja noggrannhet från precision
så vad hände med att vända alkemi, som var som magisk dryck-bryggning i Harry Potter, till vetenskapen om kemi? Det var mätning. Noggrann, noggrann mätning av kvantiteter, såsom massor, volymer, densiteter, temperaturer, tryck.
en tidig hjälte av mätning var Antoine Lavoisier., Han var en av de första sanna kemiska forskarna. Han utförde noggranna experiment och försökte inte dra några slutsatser förutom de som krävs av hans data. Han sa faktum, idé och ord bör vara så nära kopplade som möjligt: att du inte kan förbättra ditt språk utan att förbättra ditt tänkande, och du kan inte förbättra ditt tänkande utan att förbättra ditt språk. Så han banade väg för en systematisk kemisk nomenklatur som i huvudsak är vad vi använder idag., Anmärkningsvärt, om du läser hans text, skriven 1789, avsedd att introducera kemi till nybörjare, är mycket av det fortfarande helt förståeligt och till och med korrekt enligt moderna standarder.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier beskriver först materiens tillstånd: gaser, vätskor och fasta ämnen. Han påpekar när ett fast material upphettas, det tenderar att expandera, blir först en vätska, som tar upp en konstant volym, men kan hällas, till skillnad från en fast., Mer uppvärmning, och det blir en gas, som han beskriver som elastisk eftersom det kommer att expandera eller komprimera till olika volymer beroende på trycket. Till skillnad från de grekiska filosoferna förstod han att detta är en fysisk förändring, inte en kemisk förändring, och han har en bra submikroskopisk skala intuition om vad som händer: materialets partiklar förändras inte, de kommer bara längre ifrån varandra.,
han brände svavel och fosfor och kol (kol)och gjorde noggranna observationer, ofta med hjälp av klockburken över en hink kvicksilver som visas i ritningen från sin bok, Figur 1. Detta är ett exempel på en kemisk förändring eller kemisk reaktion, där reaktantkemikalier blir till olika produktkemikalier. Om du tänder svavel i skålen märkt D under klockburken av luft, brinner den tills den går ut och lämnar lite extra svavel. Luften som finns kvar i burken är inte längre bra för andning. Om du lägger en mus i burken, kommer den att dö, precis som flamman gjorde., Detta visar begreppet begränsande reaktant. Reaktionen eller bränningen stoppas när det tog slut på syre, lämnar främst kväve (och några spår andra gaser) i burken. Priestley, en annan forskare, visade honom hur man förbereder ren syregas, och han använde detta för att göra många brinnande experiment också.
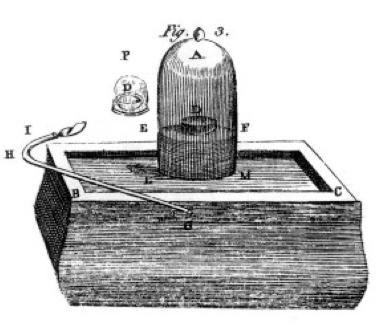
Lavoisier var besatt av mätning., Han utvecklade utarbetad apparat för att mäta allt. Han skulle bränna fosfor, som visas i Figur 1, och observera bildandet av en vit fläckig produkt. Fosforn (reaktanten i detta fall) var inte vattenlöslig, men produkten var, så han samlade produkten mycket noggrant och separerade den från den oreagerade fosforn genom att tvätta med vatten. Efter torkning kunde han mäta hur mycket fosfor som hade bränts, hur mycket syre som hade förbrukats (eftersom han visste tätheten av syregas) och hur mycket produkt som hade bildats., Han fann att massan av produkten var summan av massorna av reaktant konsumeras, i varje experiment. Detta är lagen om bevarande av massa (som faktiskt några tidigare alkemister och kemister också hade använt). Han observerade också att fosforn inte har någon smak, men produkten, som han kallade fosforsyra, är sur. Han visste från dessa experiment att element i många fall kombineras i endast vissa proportioner, och även att syre kan kombinera med svavel, fosfor etc. i två olika förhållanden., Han gav oss den terminologi vi fortfarande använder idag: svavelsyra består av svavel och mer syre, svavelsyra består av svavel och mindre syre. -ous betyder mindre syre; – ic betyder mer syre. Se sidan nomenklatur för detaljer.
Lavoisier ägnade stor uppmärksamhet åt noggrannhet och precision. Till exempel, i experimentet vi just beskrivit, mätte han gasvolymen i klockburken, före och efter reaktionen, men noterade att efter reaktionen måste du vänta tills temperaturen återgår till vad den var när du mätte ursprungligen., Om gasen är varm när du mäter volymen efter reaktionen, kommer den att ha expanderat, och din standarddensitet gäller inte. Detta skulle införa ett systematiskt fel i mätningarna: varje gång du utför experimentet kommer du att tro att det finns mer gas kvar än det faktiskt är, och din mätning kommer inte att vara korrekt. Om det genomsnittliga resultatet av ditt experiment är nära rätt värde är det korrekt. Men om ditt experiment ger mycket olika nummer varje gång, även om genomsnittet är korrekt och experimentet är korrekt, är det inte exakt., Precision är skillnaden mellan möte ”runt klockan 2″ och möte ” vid 3 minuter och 27 sekunder före 2 pm.”Precision är hur specifik du är, hur mycket detalj du använder. Lavoisier hjälpte också till att utveckla systemet med enheter (kg, L, M) som för närvarande används i Korea och många andra länder.

övergripande, medan han inte gjorde så många ursprungliga experiment som ingen annan hade gjort tidigare, gjorde han sina experiment mycket noggrant, så de var så exakta och exakta som möjligt, och sedan tänkte han på dem tydligt och skapade ord för att beskriva de kemikalier och idéer som hjälpte till att göra allt tydligare., Om du läser en Kemi lärobok skriven innan Lavoiser, kommer du att vara mycket förvirrad eftersom namnen på kemikalier skulle baseras på historia (och skulle låta som de kom från Harry Potter), snarare än att baseras på vad kemikalierna är. Om du läser en Kemi text skriven efter Lavoiser, kommer du att känna igen språket som liknar vad vi använder idag.
sammanfattning
noggrannhet beskriver hur nära ett uppmätt värde är till det faktiska värdet. Precision beskriver hur väl en grupp av uppmätta värden håller med varandra., Lagen om bevarande av massa säger att Materia varken kan skapas eller förstöras av en kemisk eller fysisk process. Detta resulterar i summan av massorna av reaktant som konsumeras i något experiment är lika med produktens massa. Kemiska förändringar innebär att ett ämnes kemiska identitet ändras så att nya ämnen bildas. Fysiska förändringar innebär att ett ämne ändras utan att dess kemiska identitet ändras. Förbränning och rost är två exempel på kemiska processer medan kokning och smältning är exempel på fysiska processer., Kemiska reaktioner innebär att reaktanter, kemikalier som konsumeras i processen med kemisk förändring, till produkter, kemikalier som produceras genom processen med kemisk förändring som har en annan sammansättning från reaktanterna. Ett begränsande reaktant bestämmer, eller gränser, mängden produkt som kan framställas från en kemisk reaktion.
utanför länk
- CrashCourse Chemistry: den grundläggande lagen (11 min)
bidragsgivare och Attributioner
-
Emily V Eames (City College of San Francisco)