introduktion
polycystiskt ovariesyndrom (PCOS) är en av de vanligaste störningarna i endokrinologi hos kvinnor i reproduktiv ålder. PCOS diagnostiseras genom att bekräfta närvaron av två av följande: oligo-och/eller anovulation, klinisk och / eller biokemisk hyperandrogenism och ultraljudsfunktioner hos polycystiska äggstockar, med undantag av andra etiologier (Fr och Tarlatzis, 2004)., Prevalensen av PCOS beror på vilka diagnostiska kriterier som används, men de kan vara upp till 18% när du använder Rotterdam diagnostiska kriterier (Rotterdam ESHRE/ASRM-Sponsrade PCOS Samförstånd Workshop-Gruppen, 2004). Hyperandrogenism finns i 60-80% av kvinnorna med PCOS (Azziz et al., 2006). De viktigaste kliniska eller biokemiska egenskaperna hos hyperandrogenism är akne, hirsutism, alopeci och seborrheisk dermatit; förhöjd testosteron, androstenedion och dehydroepiandrosteronsulfatnivåer; och minskad könshormonbindande globulin (SHBG) nivåer., Syndromet presenterar inte bara med reproduktiva manifestationer utan har också metaboliska konsekvenser inklusive insulinresistens, dyslipidemi, fetma, typ 2-diabetes och systemisk inflammation (deugarte et al., 2005; Sartor och Dickey, 2005; Escobar-Morreale et al., 2011).
medan den första linjens behandling för ägglossning induktion hos kvinnor med PCOS är klomifencitrat administrering, de antiestrogena effekterna av klomifencitrat på livmoderslemhinnan och livmoderhalsen tros orsaka en låg uppfattning hastighet av 20% (Gonen och Casper, 1990)., Klomifencitrat är också förknippat med ett antal biverkningar inklusive värmevallningar, bröst obehag, Bukspänning, illamående, kräkningar, nervositet, huvudvärk, håravfall, och störd syn (Legro et al., 2007a). Nya studier har undersökt metformins roll som ett insulinsensibiliserande medel, och även om användningen ökar är förståelsen för dess mekanism ofullständig (Legro et al., 2007b)., Dessutom kan det orsaka utveckling av flera folliklar, tillsammans med en risk för ovariell hyperstimulering, flera graviditeter och medfödda missbildningar såsom neuralrörsdefekter, vilket leder till potentiellt otillfredsställande behandlingsresultat.
eftersom PCOS definieras som en multifaktoriell metabolisk endokrin störning (Laven et al., 2002), livsstil och kost, och Medelhavsdieten i synnerhet, spelar en relevant roll, tillsammans med farmakologisk behandling (Barrea et al., 2019)., Nya studier har föreslagit att kompletterande och alternativa behandlingar, inklusive växtbaserade läkemedel och akupunktur, kan lindra PCOS-symtom, men bevis på deras effekt och säkerhet är otillräcklig. Därför måste nya behandlingsstrategier som innehåller kompletterande och alternativa terapier undersökas för att optimera behandlingen av PCOS. I denna studie granskade vi data om effekterna och underliggande mekanismer för växtbaserade läkemedel som används vid behandling av PCOS-modell i laboratorieundersökningar.,
metoder
artiklar publicerade på engelska fram till juni 30, 2018 söktes i Medline (via PubMed) och EMBASE (via Elsevier). Söktermerna var en kombination av medicinska ämnesrubriker (MeSH) termer och deras synonymer. Söktermerna som användes var följande: och .
inkluderingskriterierna för vår granskning inkluderade följande:
1. In vitro och in vivo studier som bedömde de potentiella effekterna av växtbaserade läkemedel på PCOS-modellen
2., Forskning om föreningarna isolerade från örter, enskilda växtbaserade extrakt eller örtformeldekok
3. Artiklar skrivna på engelska
uteslutningskriterierna var följande:
1. Kliniska prövningar av växtbaserade läkemedel för PCOS
2. Granska artiklar
3., Artiklar som inte beskrev komponenterna i örtmedicinen; detta var dock tillåtet när det gäller patenterade växtbaserade läkemedel
bland de hämtade studierna, efter att duplikaten tagits bort, granskades titlarna och abstrakterna för att hitta potentiellt relevanta artiklar. Därefter granskades de fullständiga texterna till granskade artiklar för att bekräfta att de uppfyllde våra inklusionskriterier.,
vi extraherade data om växtbaserade ingrepp; målcell (eller djurmodell) användning; metod för örtutvinning: administreringsväg; dosering och perioder; och resultat av föreningarna isolerade från örter, enskilda växtbaserade extrakt och örtformeldekok. Baserat på dessa data sammanfattade vi åtgärderna och mekanismerna bakom de positiva effekterna av växtbaserade läkemedel på PCOS-modellen.
resultat
Studieegenskaper
i denna översyn inkluderade vi totalt 27 studier med 22 växtbaserade läkemedel som rapporterade deras effekt på PCOS-modellen., Vi identifierade två in vitro-studier, 22 in vivo-studier och tre studier med både in vitro-och in vivo-experiment. De växtbaserade interventionerna i de 27 studierna bestod av fyra föreningar isolerade från örter (6 studier), nio enskilda örttextrakt (11 studier) och nio örtformeldekok (10 studier). Ett flödesschema för artikelvalsprocessen visas i Figur 1.
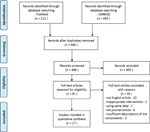
Figur 1 flödesschema för studievalsprocessen.,
växtbaserade interventioner och deras laboratorieresultat
föreningar isolerade från örter
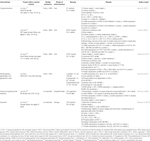
tabell 1 in vitro och in vivo studier av föreningar isolerade från örter (n=6).
individuella växtbaserade extrakt
Aloe vera (L.) Burm.f. reducerade plasmanivåer av totalkolesterol (TC), triglycerid (TG) och lågdensitetslipoproteinkolesterol (LDL-C); förhöjda lipoproteinkolesterolnivåer (HDL-C) (Desai et al.,, 2012); normaliserad follikeltillväxt; och återhämtade östrocykeln (Maharjan et al., 2010). Atractylodes macrocephala Koidz. inducerade återhämtningen av östrocykeln och minskningen av testosteronnivåer, androstenedionnivåer, det fria androgenindexet, LH-nivåer, LH / FSH-förhållandet och anti-Müllerian hormonnivåer (Zhou et al., 2016). Matricaria chamomilla L.-behandlade kvinnliga Wistar-råttor visade minskade cyster i ovarievävnad och ett ökat antal dominerande folliklar (Zangeneh et al., 2010). Cocos nucifera L., återhämtade östrogencykeln; reducerade TC, mycket låg densitet kolesterol och TG nivåer; och ökade HDL-C nivåer (Soumya et al., 2014). Linum usitatissimum L.-behandlade kvinnliga SD-råttor visade ökade antrala folliklar och gulkroppen, ett minskat antal cystiska folliklar och minskad diameter av antrala folliklar (Jelodar et al., 2018). Foeniculum vulgare Mill. inducerad normal glomerulus, normal basalmembran och kapillärer (Sadrefozalayi och Farokhi, 2014)., Zingiber officinale Roscoe sänkte nivåerna av LH och östrogen, och ökade nivåer av FSH och progesteron i neonatal kvinnliga SD-råttor (Atashpour et al., 2017). Koreanska röd ginseng (Panax ginseng C. A. Mey.)- behandlade SD-honråttor visade färre cystiska folliklar och mRNA-uttryck av NGF hos äggstockar (Pak et al., 2009, Jung m.fl., 2011). Labisia pumila var. alata förbättrade glukosinfusionshastigheten och reducerade TC-och TG-nivåer (Mannerås et al., 2010). Uppgifterna sammanfattas i Tabell 2.,
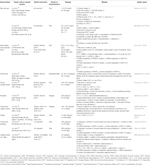
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Kinesisk örtmedicin (CHM) 1 (Root Astragali Root Rehmanniae Preparata, Cuscuta mig av kinesiska Lam, Frukt Liv Lucidi, Frukt Psoraleae, Roten av Salviae Miltiorrhizae och hallon Linn) och CHM 2 (Cuscuta mig av kinesiska Lam, Frukt Liv Lucidi, och hallon Linn) inducerad återvinning av estrous cykel och LH/FSH-kvot och reduktion av androstendion bör nivåer och gratis androgen index (Gu et al., 2015)., Gui Zhu Yi Kun formel (GZYKF) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia, och Luffa cylindriska) minskade mRNA-uttryck av Beclin 1, lätt kedja 3, och tumörhämmande p53 (Xing et al., 2017). HemoHIM (Angelica Radix, Cnidii Rhizoma, och Paeonia Radix)-behandlade SD kvinnliga råttor visade ökat i antal och storlek av corpora lutea och en minskad nivå av NGF protein i äggstockarna (Kim et al., 2009). Heqi san befanns minska LH och testosteronnivåer, och för att mildra insulinresistens (Zhao et al., 2017)., En ny växtbaserade immunmodulerande läkemedel (imod) (Rosa canina, Urtica dioica och Tanacetum vulgare)-behandlade kvinnliga Albino Wistar råttor visade färre incidenser av äggstocks atretiska och cystiska folliklar, och ett högre antal corpora lutea (Rezvanfar et al., 2012). Kyung-Ok-Ko (KOK) administration inducerad återvinning av estrous cykel och kluster av differentiering (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, monocyter chemoattractant protein (MCP)-1, och iNOS-mRNA-uttryck minskning i äggstockarna kvinnliga SD-råttor (Jang et al., 2014; Lee et al., 2016)., Kvinnliga SD-råttor som behandlats med Xiao Yao-San (XYS) (radix bupleuri, angelica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, ingefära, mynta, och glycyrrhizae) visade ett minskat antal cystisk hårsäckarna och sänkt terminal deoxynucleotidyl metyltransferas dUTP nick slutet märkning (TUNEL) positiva celler i antral folliklar (Sun et al., 2017). Uppgifterna sammanfattas i tabell 3.

tabell 3 in vitro och in vivo studier av örtformeldekok (n=10).,
åtgärder av växtbaserade läkemedel för behandling av PCOS

tabell 4 Åtgärder av växtbaserade läkemedel för behandling av PCOS.
verkningsmekanismerna för PCOS

tabell 5 verkningsmekanismerna för växtbaserade läkemedel på PCOS.,
diskussion
vår granskning av litteraturen som publicerades fram till juni 30, 2018 sammanfattade resultaten av in vitro-och in vivo-studier om effekten av växtbaserade läkemedel för behandling av PCOS-modell. Totalt fyra föreningar isolerade från örter (6 studier), nio enskilda örttextrakt (11 studier) och nio örtformeldekok (10 studier) befanns ha hämmande effekter på PCOS., Enligt de rapporterade resultaten normaliserade växtbaserade läkemedel kvinnliga hormoner, minskade manliga hormoner, återhämtade östrocykeln, förbättrade insulinresistens och förbättrad lipidmetabolism. Vi fann att den potentiella hämmande aktiviteten hos växtbaserade läkemedel kan påverka olika aspekter av PCOS, med de positiva effekterna av växtbaserade läkemedel som uppstår huvudsakligen genom anti-inflammation, Anti-oxidativ stress, hämning av autofagi eller apoptos och ovarial NGF-reduktion.,
växtbaserade läkemedel kan hämma inflammatoriska tillstånd hos PCOS
nya studier har ytterligare utforskat etiologin och patologin hos PCOS. Forskare fann att i mikromiljön hos patienter med PCOS är mild kronisk inflammation ett kännetecken för syndromet (Nestler, 2000). PCOS har varit relevant i kronisk inflammation (Benson et al., 2008), och makrofager har varit dess huvudsakliga patogenes (Wu et al., 2004). Äggstocks makrofager producerar cytokiner, kemokiner och tillväxtfaktorer i både normala och inflammatoriska processer i äggstocken., Makrofagerna kan orkestrera apoptos och vävnadsremodellering, som är involverade i follikulogenes, ägglossning och bildning av corpus luteum (Benson et al., 2008). Med tanke på makrofagernas kritiska roll i PCOS (Benson et al., 2008), Många studier har jämfört cytokinnivåer i serum och i follikulära vätskor hos PCOS-patienter. Nivåerna av TNF-α och IL-6 i serum och i follikulära vätskor var förhöjda hos icke-överviktiga/icke-diabetiska PCOS-patienter som behandlades med gonadotropiner (Amato et al., 2003)., Makrofag inflammatoriskt protein-1α och MCP-1 ökade hos PCOS-patienter och associerade med adiposity (Glintborg et al., 2009). iNOS, cyklooxygenas-2 (COX-2) och transformerande tillväxtfaktor (TGF)-β-aktivitet ökade hos äggstockarna hos PCOS-patienter (Elia et al., 2006; Hatzirodos et al., 2011), och iNOS och COX-2 aktivitet förhindrades genom metformin administrering (Elia et al., 2006). Dessa resultat tyder på att immunsystemet är relevant för patogenesen av PCOS., Därför kan nya lösningar som riktar sig till denna inflammatoriska process vara ett terapeutiskt alternativ till den nuvarande behandlingen.
i denna översyn hämmade iridoider signifikant IL-1β, IL-6, IL-10 och iNOS-uttryck, vilket hämmade inflammatoriska tillstånd (Zuo et al., 2017). Quercetin minskade också signifikant nivåerna av IL-1β, IL-6 och TNF-α, och minskad nukleär translokation av nukleär faktor kappa B (NF-kB) i en insulinresistent PCOS-råttmodell (Wang et al., 2017)., Pre-administrering av KOK minskade det ökade uttrycket av joniserad kalciumbindande adaptermolekyl -1 (+) makrofager i theca cellskiktet av cystor och stroma. KOK också ökade mRNA-uttryck av CD11b och CD3 i PCOS äggstocksvävnad. Pre-administrering av KOK minskade signifikant de ökade nivåerna av IL-1β, IL-6, IL-8, TNF-α, MCP-1 och iNOS; och ökade det reducerade mRNA-uttrycket av epidermal tillväxtfaktor och TGF-β hos PCOS-äggstockar., Dessa resultat visade att KOK reglerar uttryck av inflammatoriska mediatorer i dehydroepiandrosteron (DHEA)-inducerad PCOS modell (Jang et al., 2014). Inflammatoriska mediatorer reglerades också i livmoderns endometrium genom Kok-administrering, vilket har visat sig förhindra endometrial hyperplasi i PCOS-modeller (Lee et al., 2016). Det var också visat att TNF-α i serum och prostaglandin E (PGE) i äggstockarna minskade med IMODs (Rezvanfar et al., 2012).,
växtbaserade läkemedel kan dämpa oxidativ Stress i PCOS
reaktiva syrearter är viktiga signalmolekyler vid reglering av fysiologiska funktioner vid kvinnlig reproduktion, inklusive steroidogenes, follikulogenes, oocytmognad, gulkroppsfunktion och luteolys (Agarwal et al., 2005). Dessutom spelar de en nyckelroll i de patologiska processerna för kvinnlig reproduktion (Agarwal et al., 2003; Agarwal et al., 2008)., Oxidativ stress är ett tillstånd där jämvikten mellan kroppens antioxidantkapacitet och giftiga syre – och/eller kvävebaserade produkter försämras. Följaktligen är fria radikaler otillräckligt avgiftade av cellulära antioxidanter. Oxidativ stress spelar en viktig roll i den kvinnliga reproduktionen (Ruder et al., 2008; Ruder m.fl., 2009; Vakilian et al., 2009), och det finns ökande litteratur om effekterna av ökade oxidativa stressmarkörer hos infertila kvinnor, och om deras medverkan i patofysiologin av PCOS (Joo et al., 2010; Mohamadin et al., 2010)., PCOS kännetecknas av kronisk inflammation, oxidativ stress och onormal microRNA uttryck (Zhao et al. År 2015; att Göra et al., 2016). Eftersom det är känt att inflammation och oxidativ stress är nära kopplade, resulterar förhöjd oxidativ stress vanligtvis från och leder till ett inflammatoriskt tillstånd (Zuo et al., 2016). Det är svårt att skilja inflammation från oxidativ stress, och det har föreslagits under de senaste åren att inflammation och oxidativ stress utgör den huvudsakliga grunden för sjukdomsförekomst (Duleba och Dokras, 2012).
i den här översynen, Imods (Rezvanfar et al.,, 2012) och iridoids (Zuo et al., 2017) visade positiva effekter på oxidativ / nitrosativ stress, antingen direkt eller indirekt, huvudsakligen genom att minska fria radikaler och hämma inflammatoriska cytokiner hos PCOS-råttor. Administrering av imods minskade signifikant lipidperoxidation (en markör för oxidativ stress) och ökat superoxiddismutas, katalas och glutationperoxidas (markörer för antioxidantpotential) nivåer i hyperandrogenisminducerade PCOS. Dessutom reducerades peroxynitrit (en markör för nitrosativ stress), TNF-α och PGE-nivåerna signifikant av imods., Dessutom överensstämde dessa effekter av imods med histologiska bevis, vilka visade en signifikant förbättring av follikulogenes mikroskopiska egenskaper jämfört med dem i kontrollgruppen (Rezvanfar et al., 2012). NF-kB-signalsystemet är känt som ett dominerande paradigm för specifika signaltransduktionsmolekyler, genaktivering och regulatoriska proteiner som svar på inflammation (Ivanenkov et al., 2011)., Iridoiderna dämpade effektivt den lipopolysackaridinducerade höjden av IkB-fosforyleringsnivåer, minskade IkB-uttrycksnivåer och minskade NF-kB P65, vilket indikerar att iridoiderna utövar sina antioxidanteffekter via NF-kB-vägen (Zuo et al., 2017).
växtbaserade läkemedel kan reglera apoptos och/eller autofagi i PCOS
överlevnaden eller döden av granulosaceller är erkänd som en kritisk faktor som påverkar folliklarnas öde (Matsuda et al., 2012). Apoptos och autofagi är två former av programmerad celldöd., Autofagi är den process genom vilken en autofagosom, som är en dubbelmembranvesikel, bär cytoplasmiskt material till lysosomen (Mizushima och Komatsu, 2011). Det har rapporterats att både apoptos och autofagi kan induceras i granulosaceller och att de är involverade i kontrollen av follikelutveckling (Choi et al., 2010, Choi m.fl., 2013). Granulosaceller är erkända som kritiska aktörer i follikelutveckling. De producerar östradiol, insulinliknande tillväxtfaktorer och andra cytokiner i äggstocken och uttrycker receptorerna för östradiol, LH och FSH (Juengel et al.,, 2006), som alla deltar i regleringen av follikelutveckling. Således kan eventuell försämring av granulosacellerna leda till oordnad utveckling av folliklar.
under det senaste decenniet har autofagi-relaterade signalvägar och deras huvudsakliga proteinregulatorer identifierats. Rat microtubule-associated protein 1 light chain 3 är associerad med autofagosommembranbehandling (Kabeya et al., 2000). Beclin-1 har också visat sig ha en kritisk roll vid autofagosombildning (Von Hoven et al., 2012)., Vidare har tidigare studier identifierat tumörsuppressor p53 (p53) som en dubbel modulator av autofagi vid reglering av celldöd eller överlevnad (Vousden och Ryan, 2009; Zhang et al., 2010). Vid låga energinivåer kan adenosinmonofosfataktiverat proteinkinas (AMPK), som aktiveras av p53, aktivera tuberös skleroskomplex 2 och hämma därför det däggdjursmål av rapamycin (mTOR) aktivitet och öka autofagi (Feng et al., 2007)., I denna översyn, p53, som aktiveras av gzykf i kärnan, i sin tur aktiveras AMPK och sestrin, som fungerar som en återkoppling i mTOR inhibering, därigenom aktivera autofagi. Autofagi moduleras också av fosfoinositid 3-Kinas/proteinkinas B (PI3K/Akt) signalvägar (Pyo et al., 2012). I denna översyn lindrade XYS minskningen av fosforylering av ribosomalt protein S6-kinaspolypeptid i och Akt, liksom ökningen av mikrotubulassocierad proteinljuskedja 3-i till mikrotubulassocierad proteinljuskedja 3-II-omvandling både in vivo och in vitro (Sun et al., 2017).,
endometrierna hos de flesta PCOS-patienter är tjocka och uppvisar enkel, komplicerad eller atypisk hyperplasi eller malign transformation som kan korreleras med endometrial cellapoptos (Villavicencio et al., 2007). Hyperandrogenism inducerad av DHEA är associerad med ett större antal apoptotiska celler i endometriet, och metformin (ett insulinomimetiskt eller insulinsensibiliserande medel) kan minska det ökade antalet apoptotiska celler (Elia et al., 2009). I denna översyn utvärderades apoptotisk celldöd av TUNELFÄRGNING., Apoptotiska celler detekterades sällan genom TUNELFÄRGNING i Shams livmodervävnad eller den KOK-ensamma gruppen. Antalet TUNEL-positiva celler ökade emellertid i DHEA-gruppens endometrium. Det ökade antalet apoptotiska celler reducerades signifikant efter administrering av KOK. Dessa resultat indikerar att före administrering av KOK hämmade DHEA-inducerad endometrial missbildning genom att minska endometrial apoptos (Lee et al., 2016).,
Växtbaserade Läkemedel Kan Minska Nivån av NGF i PCOS
Tidigare studier har visat att PCOS är förknippade med onormal aktivering av det sympatiska nervsystemet, vilket resulterar i ökad catecholaminergic nerver (Semenova, 1969), nedsatt noradrenalin metabolism (Garcia-Rudaz et al., 1998), och ökad aktivitet av sympatiska nerver via den överlägsna äggstocksnerven (Lara et al., 1993)., Utvecklingen och funktionen hos ovariesympatisk innervation beror på äggstocken för produktion av NGF, en målbaserad neurotrofin som krävs för perifer sympatisk systemutveckling (Levi-Montalcini, 1987). Neurotrofinfamiljen, implicerar NGF-receptorn och NGF mRNA i ägglossningen och i patofysiologin hos PCOS (Lara et al., 2000; Stener-Victorin et al., 2003). I rått äggstockar syntetiseras NGF huvudsakligen i cellerna i follikelväggen (Dissen et al.,, 1996) och i PCOS kan aktiveringen av NGF vara en faktor som är involverad i att förbättra norepinefrin utflöde till körteln, vilket induceras av östradiolvalerat (EV) (Lara et al., 2000) PCOS uppvisar en hög intraovariell nervfiberdensitet som är associerad med sympatisk hyperresponsivitet (Stener-Victorin et al., 2003).
i denna översyn minskade administreringen av örtformlerna Changbudodam-Tang och Yongdamsagan-Tang signifikant förhöjd NGF i äggstockarna med liten effekt på hjärnvävnad (Lee et al., 2003)., HemoHIM normaliserade också NGF, sänkte det höga antalet antrala folliklar och ökade antalet corpora lutea i PCOS. Dessa resultat överensstämmer med tidigare studier om de positiva effekterna av HemoHIM vid förebyggande och behandling av PCOS (Pak et al., 2009). Dessutom administrering av koreanska röda ginseng extrakt (Pak et al., 2009, Jung m.fl., 2011) och koreanska röda ginseng totala saponiner (Pak et al., 2005) minskade signifikant uttrycket av NGF-protein och NGF mRNA, jämfört med de hos EV-behandlade äggstockar.,
denna studie granskade bevis för växtbaserade läkemedel som kan användas för att behandla PCOS och dess associerade symtom, och resultaten är avsedda att lägga till klinikernas förståelse av verkningsmekanismerna för växtbaserade läkemedel vid PCOS-behandling. Den största begränsningen av vår studie är heterogeniteten av interventioner. Vidare utförde vår studie inte en kvalitetsbedömning av varje studie eller en kvantitativ syntes av resultaten. Ytterligare studier som inkluderar metodologisk kvalitetsbedömning och kvantitativ syntes av resultat är motiverade.,
slutsats
i denna översyn uppvisade totalt 27 studier med 22 växtbaserade läkemedel positiva effekter på PCOS. Herbal interventions i de 27 studierna bestod av fyra föreningar isolerade från örter (6 studier), nio individuella örttextrakt (11 studier) och nio örtformeldekok (10 studier). Växtbaserade läkemedel visades normalisera kvinnliga hormoner, minska manliga hormoner, återställa östrogencykeln, förbättra insulinresistensen och förbättra lipidmetabolismen i PCOS., De mekanismer som ligger till grund för de positiva effekterna av växtbaserade läkemedel på PCOS är förknippade med anti-inflammation, Anti-oxidativ stress, hämning av autofagi och/eller apoptos och ovariell NGF-reduktion. Växtbaserade läkemedel kan betraktas som lovande resurser vid utvecklingen av effektiva terapeutiska medel för PCOS.
Författarbidrag
i-HC och KP utformade studien. C-YK och KP sökte artiklar och analyserade data. KP skrev manuskriptet och i-HC reviderade det. Alla författare bidrog till artikeln och godkände den inlämnade versionen.,
finansiering
detta arbete stöddes av National Research Foundation of Korea (NRF) bidrag finansierat av Koreas regering (Msip) (nr.NRF-2017R1C1B1006387) och den koreanska Samhället av Ginseng (2019).
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE/ASRM-Sponsrade PCOS Samförstånd Workshop-Gruppen (2004). Reviderad 2003 konsensus om diagnostiska kriterier och långsiktiga hälsorisker i samband med polycystiskt ovariesyndrom. Fertilitetssterilitet 81 (1), 19-25. doi: 10.1016 / j. fertnstert.2003.10.004
CrossRef Full Text | Google Scholar
Semenova, I. (1969). Adrenerg innervation av äggstockar i Stein-Leventhal syndrom. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), s.58.
Google Scholar