termodynamik är en gren av fysikersom handlar om energi och arbete i ett system.Termodynamiken handlar bara om det stora ansvaret för ett system som vi kan observera och mäta i experiment. Småskaliga gasinteraktioner ärbeskrivs av den kinetiska teorin om gaser.Det finns tre principallaws av termodynamik som beskrivs på separata diabilder., Varjelag leder till definitionen avtermodynamiska egenskapersom hjälper oss att förstå och förutsäga driften av ett fysikaliskt system. Vi kommer att presentera några enkla exempel på dessa lagar ochegenskaper för en mängd olika fysiska system, även om vi är mest intresserade av propulsionssystemens termodynamik och höga hastighetsflöden.Lyckligtvis många avklassiska exempel på termodynamik innebär gasdynamik.,
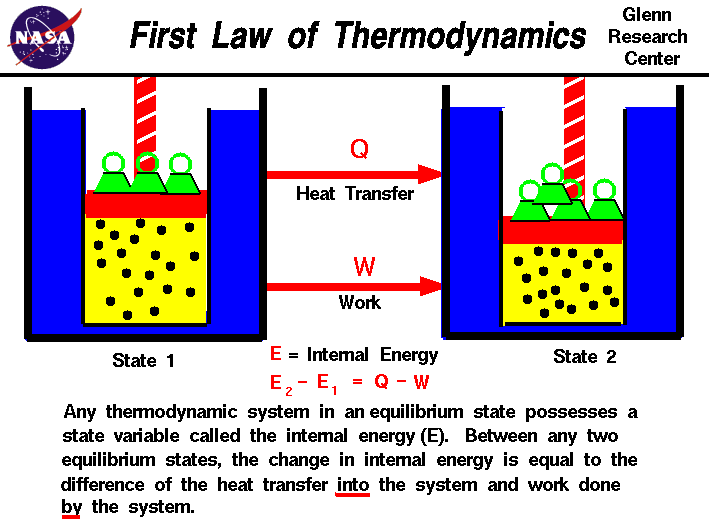
i våra observationer av det arbete som utförts på, eller med en gas, har vi funnit att mängden arbete inte bara beror på de första och sista tillstånden i gasenmen också på processen, eller väg som producerar det slutliga tillståndet.På samma sätt beror mängden värme som överförs till eller från en gas också på de ursprungliga och slutliga tillstånden och processen som producerar det slutliga tillståndet., Många observationer av realgaser har visat att skillnaden i värmeflödet i gasenoch det arbete som utförs av gasen beror endast på gasens initiala och finalstater och beror inte på processen eller vägensom producerar det slutliga tillståndet. Detta tyder på förekomsten av anytterligare variabel, kallad gasens inre energi, vilket bara beror på gasens tillstånd och inte på någon process.Den inre energin är en tillståndsvariabel, precis som temperaturen ellertrycket., Termodynamikens första lag definierar det inreenergi (E) som lika med skillnaden i värmeöverföringen (Q) intoa-systemet och det arbete (W) som utförs av systemet.
E2 – e1 = Q – w
Vi har betonatorden ”till” och ”av” i definitionen. Värme borttagen från ett systemskulle tilldelas ett negativt tecken i ekvationen. På samma sätt är workdone på systemet tilldelat ett negativt tecken.,
den inre energin är bara en form av energi som potentialenergin hos ett objekt på en viss höjd över jorden, eller kinetikenergin hos ett föremål i rörelse. På samma sätt som potentiell energi kan omvandlas till kinetisk energi samtidigt som systemets totala energi bevaras, kan den interna energin i ett termodynamiskt system konverteras till antingen kinetisk eller potentiell energi. Liksom potentialenergi kan den interna energin lagras i systemet.Observera dock att värme ocharbete kan inte lagras eller bevaras oberoende eftersom de är beroende av processen., Termodynamikens första lag gör det möjligt för mångamöjliga tillstånd för ett system att existera, men endast vissa stater ärfunna att existera i naturen. Den andra termodynamikens lag bidrar till att förklara denna observation.
om ett system är helt isolerat från den yttre miljön är det möjligt att ändra tillståndet där ingen värme överförs till systemet. Forskare hänvisar till en process som inte innebär heattransfer som en adiabatisk process.,Genomförandet av termodynamikens första lag för gaser introducerar en annananvändbar statsvariabel som kallas entalpywsom beskrivs på en separat sida.
aktiviteter:
guidade turer
 termodynamik:
termodynamik:
navigering ..
![]()
![]()
![]()
Nybörjarguide hemsida