en katalysator är ett ämne som snabbar upp en kemisk reaktion, men inte förbrukas av reaktionen; därför kan en katalysator återvinnas kemiskt oförändrad i slutet av reaktionen den har använts för att påskynda, eller katalysera.

diskussion
för kemikalier att reagera måste deras bindningar omarrangeras, eftersom bindningarna i produkterna skiljer sig från dem i reaktanterna.,Det långsammaste steget i bond omläggning producerar vad som kallas ett övergångstillstånd – en kemisk art som varken är en reaktant eller en produkt, men är en mellanprodukt mellan de två.
energi krävs för att bilda övergångstillstånd. Denna energi kallas aktiveringsenergi, eller Ea.Att läsa diagrammet nedan från vänster till höger visar utvecklingen av en reaktion som reaktanter passerar genom övergångstillståndet för att bli produkter.,
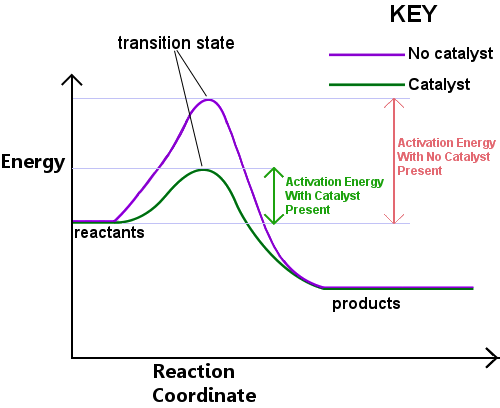
aktiveringsenergin kan ses som ett hinder för en kemisk reaktion, ett hinder som måste korsas.Om barriären är hög har få molekyler tillräcklig kinetisk energi för att kollidera, bilda ett övergångstillstånd och korsa barriären.Reaktanter med energi lägre än Ea kan inte passera genom övergångstillståndet för att reagera och bli produkter.
en katalysator fungerar genom att tillhandahålla en annan väg, med lägre Ea, för reaktionen. Katalysatorer sänker energibarriären.,Den olika vägen gör det möjligt för bond-omarrangemangen som behövs för att omvandla reaktanter till produkter att ske lättare, med en lägre energi input.In varje givet tidsintervall tillåter närvaron av en katalysator en större andel av reaktantarterna att hämta tillräcklig energi för att passera genom övergångstillståndet och bli produkter.
exempel 1: Haber-processen
Haber-processen, som används för att göra ammoniak från väte och kväve, katalyseras av järn, vilket ger atomställen där reaktantbindningarna kan omorganisera lättare för att bilda övergångstillståndet.,
exempel 2: enzymer
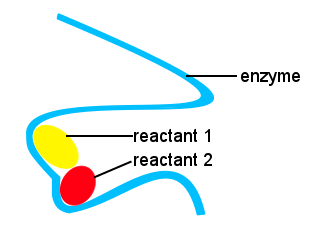
i våra kroppar, och i andra levande saker används enzymer för att påskynda biokemiska reaktioner. Ett enzym är en typ av katalysator.Komplext liv skulle vara omöjligt utan enzymer för att tillåta reaktioner att ske med lämpliga hastigheter.Formerna av enzymer tillsammans med platser på enzymet som binder till reaktanterna ger en alternativ reaktionsväg, vilket gör att specifika molekyler kan komma ihop för att bilda ett övergångstillstånd med en minskad aktiveringsenergibarriär.,
i det schematiska nedan ger det långa kedjeenzymet platser för reaktantmolekyler att komma ihop för att bilda ett övergångstillstånd med låg aktiveringsenergi.
katalysatorer kan inte flytta positionen för en kemisk jämvikt – de framåtriktade och bakåtriktade reaktionerna accelereras så att jämviktskonstanten Keq är oförändrad.Genom att ta bort produkter från reaktionsblandningen när de bildas kan den totala produktbildningsgraden i praktiken ökas.