umiejętności rozwijania
- zrozumieć, dlaczego Lavoisier jest czasami nazywany „ojcem współczesnej chemii”
- odróżnić dokładność od precyzji
co więc stało się z alchemią, która była jak magiczne zaparzanie eliksirów w Harrym Potterze, W Nauka chemii? To był pomiar. Staranny, staranny pomiar ilości, takich jak masy, objętości, gęstości, temperatury, ciśnienia.
wczesnym bohaterem pomiarów był Antoine Lavoisier., Był jednym z pierwszych prawdziwych naukowców chemicznych. Prowadził staranne eksperymenty i nie wyciągał żadnych wniosków poza tymi wymaganymi przez jego dane. Powiedział, że fakt, idea i słowo powinny być ze sobą tak ściśle powiązane, jak to tylko możliwe: że nie możesz poprawić swojego języka bez poprawy myślenia i nie możesz poprawić swojego myślenia bez poprawy swojego języka. Był pionierem systematycznej nomenklatury chemicznej, której używamy dzisiaj., Co ciekawe, jeśli czytasz jego tekst, napisany w 1789 roku, mający na celu wprowadzenie chemii dla początkujących, wiele z nich jest nadal całkowicie zrozumiałe, a nawet poprawne według współczesnych standardów.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier najpierw opisuje stany materii: gazy, ciecze i ciała stałe. Wskazuje, gdy stały materiał jest ogrzewany, ma tendencję do rozszerzania się, stając się najpierw cieczą, która zajmuje stałą objętość, ale może być wylana, w przeciwieństwie do ciała stałego., Więcej ogrzewania i staje się gazem, który opisuje jako elastyczny, ponieważ rozszerzy się lub spręży do różnych objętości w zależności od ciśnienia. W przeciwieństwie do greckich filozofów rozumiał, że jest to zmiana fizyczna, a nie chemiczna, i ma dobrą submikroskopową intuicję tego, co się dzieje: cząstki materiału się nie zmieniają, po prostu oddalają się od siebie.,
spalił siarkę, fosfor i węgiel drzewny (węgiel) i dokonał dokładnych obserwacji, często używając słoika dzwonu nad wiadrem rtęci, jak pokazano na rysunku z jego książki, rysunek 1. Jest to przykład zmiany chemicznej lub reakcji chemicznej, w której reagujące chemikalia przekształcają się w różne chemikalia produktu. Jeśli zapalisz siarkę w naczyniu oznaczonym D pod słoikiem dzwonu powietrza, pali się, dopóki nie zgaśnie, pozostawiając trochę dodatkowej siarki. Powietrze pozostające w słoiku nie jest już dobre do oddychania. Jeśli włożysz mysz do słoika, umrze, tak jak płomień., To demonstruje koncepcję ograniczającego reagenta. Reakcja lub spalanie ustały, gdy zabrakło tlenu, pozostawiając głównie azot (i kilka śladowych innych gazów) w słoiku. Priestley, inny naukowiec, pokazał mu, jak przygotować czysty Gaz tlenowy, a on użył tego do wielu eksperymentów spalania, jak również.
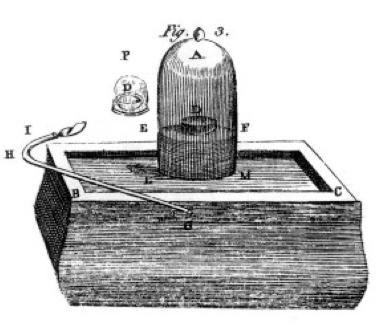
Lavoisier miał obsesję na punkcie pomiaru., Opracował rozbudowaną aparaturę do pomiaru wszystkiego. Spalał fosfor, jak pokazano na rysunku 1, i obserwował powstawanie białego produktu łuszczącego się. Fosfor (reagent w tym przypadku) nie był rozpuszczalny w wodzie, ale produkt był, więc zebrał produkt bardzo ostrożnie, oddzielając go od nieodwracalnego fosforu przez przemywanie wodą. Po wyschnięciu mógł zmierzyć, ile fosforu spaliło się, ile tlenu zostało zużyte (ponieważ znał gęstość gazu tlenowego) i ile Produktu się uformowało., Odkrył, że masa produktu jest sumą mas reagentu zużywanego w każdym eksperymencie. Jest to prawo zachowania masy (które w rzeczywistości stosowali również niektórzy wcześniejsi alchemicy i chemicy). Zauważył również, że fosfor nie ma smaku, ale produkt, który nazwał kwasem fosforowym, jest kwaśny. Wiedział z tych eksperymentów, że w wielu przypadkach elementy łączą się tylko w pewnych proporcjach, a także, że tlen może łączyć się z siarką, fosforem itp. w dwóch różnych proporcjach., Podał nam terminologię, której nadal Używamy: kwas siarkowy składa się z siarki i więcej tlenu, kwas siarkowy składa się z siarki i mniej tlenu. – ous oznacza mniej tlenu; – ic oznacza więcej tlenu. Szczegóły na stronie nomenklatury.
Lavoisier przykładał szczególną uwagę do dokładności i precyzji. Na przykład, w eksperymencie, który właśnie opisaliśmy, zmierzył objętość gazu w słoiku dzwonu, przed i po reakcji, ale zauważył, że po reakcji, trzeba poczekać, aż temperatura powróci do tego, co było, kiedy zmierzono pierwotnie., Jeśli gaz jest gorący, gdy mierzysz jego objętość po reakcji, rozszerzy się, a standardowa gęstość nie będzie miała zastosowania. Wprowadziłoby to systematyczny Błąd w pomiarach: za każdym razem, gdy wykonasz eksperyment, pomyślisz, że zostało więcej gazu niż w rzeczywistości, a twój pomiar nie będzie dokładny. Jeśli średni wynik eksperymentu jest zbliżony do prawidłowej wartości, jest on dokładny. Jeśli jednak Twój eksperyment daje bardzo różne liczby za każdym razem, nawet jeśli średnia jest poprawna, a eksperyment jest dokładny, nie jest precyzyjny., Precyzja to różnica między spotkaniem „około godziny 2″ a spotkaniem ” na 3 minuty i 27 sekund przed godziną 14.”Precyzja jest tym, jak konkretny jesteś, ile szczegółów używasz. Lavoisier pomógł również opracować system jednostek (kg, L, m), które są obecnie używane w Korei i wielu innych krajach.

Ogólnie rzecz biorąc, chociaż nie robił zbyt wielu oryginalnych eksperymentów, których nikt inny nie robił wcześniej, robił swoje eksperymenty bardzo starannie, więc były one tak dokładne i precyzyjne, jak to możliwe, a następnie myślał o nich jasno i stworzył słowa opisujące chemikalia i pomysły, które pomogły wszystko wyjaśnić., Jeśli przeczytasz podręcznik chemii napisany przed Lavoiserem, będziesz bardzo zdezorientowany, ponieważ nazwy chemikaliów byłyby oparte na historii (i brzmiałyby tak, jakby pochodziły z Harry ' ego Pottera), a nie na tym, czym są chemikalia. Jeśli przeczytasz tekst chemii napisany po Lavoiserze, rozpoznasz język jako podobny do tego, czego używamy dzisiaj.
podsumowanie
dokładność opisuje, jak blisko jest zmierzona wartość do rzeczywistej wartości. Precyzja opisuje, jak dobrze Grupa mierzonych wartości zgadzają się ze sobą., Prawo zachowania masy stwierdza, że materia nie może zostać wytworzona ani zniszczona w procesie chemicznym lub fizycznym. Powoduje to, że suma mas reagentu zużywanego w każdym eksperymencie jest równa masie produktu. Zmiany chemiczne obejmują zmianę tożsamości chemicznej substancji tak, że powstają nowe substancje. Zmiany fizyczne polegają na zmianie substancji bez zmiany jej tożsamości chemicznej. Spalanie i rdzewienie to dwa przykłady procesów chemicznych, podczas gdy gotowanie i topienie to przykłady procesów fizycznych., Reakcje chemiczne obejmują obracanie reagentów, substancji chemicznych, które są zużywane w procesie zmiany chemicznej, w produkty, substancje chemiczne wytwarzane w procesie zmiany chemicznej, które mają inny skład niż reagentów. Reagent ograniczający określa lub ogranicza ilość produktu, który może być wytwarzany w wyniku reakcji chemicznej.
link zewnętrzny
- Chemia CrashCourse: the Fundamental Law (11 min)
autorzy i atrybuty
-
Emily V Eames (City College of San Francisco)