The chemical element hafnium is classed as a transition metal . It was discovered in 1923 by Georg von Hevesy and Dirk Coster.

Data Zone
| Classification: | Hafnium is a transition metal |
| Color: | silvery |
| Atomic weight: | 178.,49 |
| State: | solid |
| Melting point: | 2230 oC, 2503 K |
| Boiling point: | 4600 oC, 4873 K |
| Electrons: | 72 |
| Protons: | 72 |
| Neutrons in most abundant isotope: | 108 |
| Electron shells: | 2,8,18,32,10,2 |
| Electron configuration: | 4f14 5d2 6s2 |
| Density @ 20oC: | 13.,2 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 13.6 cm3/mol |
| Structure: | hcp: hexagonal close pkd |
| Hardness: | 5.5 mohs |
| Specific heat capacity | 0.14 J g-1 K-1 |
| Heat of fusion | 27.2 kJ mol-1 |
| Heat of atomization | 621 kJ mol-1 |
| Heat of vaporization | 575.,0 kJ mol-1 |
| 1st ionization energy | 658.5 kJ mol-1 |
| 2nd ionization energy | 1440 kJ mol-1 |
| 3rd ionization energy | 2250 kJ mol-1 |
| Electron affinity | 178 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 1.,3 |
| objętość polaryzacji | 16.,none |
| Oxide(s) | HfO2 |
| Hydride(s) | HfH2 |
| Chloride(s) | HfCl4 |
| Atomic radius | 155 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 23.,2 W M-1 K-1 |
| Przewodność elektryczna | 3,4 x 106 S m-1 |
| temperatura zamarzania/topnienia: | 2230 oC, 2503 K |

Hafn metal ma Srebrny kolor. Zwykle wydaje się raczej szary ze względu na warstwę tlenku, który tworzy w powietrzu. Proszek hafnu, bez warstwy tlenku, może zapalać się spontanicznie w powietrzu. Zdjęcie Nr Ref., (1)
odkrycie hafnu
istnienie hafnu zostało pierwotnie przepowiedziane przez rosyjskiego chemika Dmitrija Mendelejewa. W swojej książce z 1869 roku „The Periodic Law of the Chemical Elements” przewidział istnienie pierwiastka o podobnych właściwościach, ale cięższego od tytanu i cyrkonu.
w 1911 roku Georges Urbain, odkrywca ziem rzadkich lutetium, uznał, że odkrył pierwiastek 72 podczas analizy widmowej ziem rzadkich. Nazwał ten nowy pierwiastek celtium, ale trzy lata później wykazano, że jest to mieszanina już odkrytych lantanidów., (2)
w 1921 roku Neils Bohr zasugerował węgierskiemu chemikowi Georgowi von Hevesy ' emu poszukiwanie brakującego pierwiastka w Rudzie cyrkonu. (3) zgodnie z kwantową teorią struktury atomowej Bohra, metale te miałyby podobne właściwości chemiczne, więc była duża szansa, że znajdą się w tych samych rud.
za radą Bohra Hevesy i holenderski fizyk Dirk Coster odkrył Hafn w 1923 roku za pomocą spektroskopii rentgenowskiej do analizy rud cyrkonu.
Anton Eduard van Arkel i Jan Hendrik de Boer w 1925 roku odkryli metodę wytwarzania hafnu o wysokiej czystości., Tetraodek hafnu (HfI4) rozkłada się na białym gorącym żarniku wolframowym, tworząc Kryształowy Pasek czystego hafnu. Jest to znane jako proces crystal bar.
element został nazwany Hafnium od łacińskiej nazwy „Hafnia”, co oznacza Kopenhaga, miasto, w którym pierwiastek został odkryty.

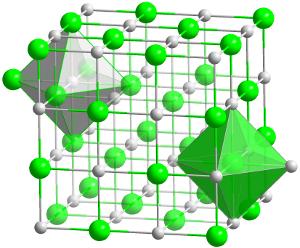
struktura krystaliczna węglika hafnu (HFC)., Jest to najbardziej ogniotrwały (żaroodporny) związek znany z dowolnych dwóch pierwiastków w stosunku 1:1.

Hafn jest używany w prętach kontrolnych reaktora jądrowego w atomowych okrętach podwodnych

biały tlenek hafnu (IV) (HfO2). Związki na bazie tlenku hafnu są wprowadzane do układów krzemowych w celu produkcji mniejszych, wysokowydajnych procesorów o zwiększonej wydajności energetycznej.,
wygląd i właściwości
szkodliwe działanie:
Hafn jest uważany za nietoksyczny. W postaci sproszkowanej jest piroforyczny (może zapalać się spontanicznie).
charakterystyka:
Hafn jest błyszczącym, srebrzystym, sferoidalnym metalem.
chemicznie jest podobny do cyrkonu.
gdy występuje w związkach, Hafn występuje głównie w stanie utleniania IV.
Hafn jest odporny na korozję z powodu tworzenia się warstwy tlenku na odsłoniętych powierzchniach.
nie ma wpływu na wszystkie kwasy (oprócz fluorowodoru) i wszystkie zasady.,
Hafn reaguje z halogenami tworząc tetrahalidy, a w wysokich temperaturach reaguje z węglem, borem, azotem, tlenem, krzemem i siarką.
zastosowania hafnu
Hafn jest używany do prętów kontrolnych reaktora jądrowego ze względu na jego zdolność do pochłaniania neutronów i jego dobre właściwości mechaniczne i odporność na korozję. Jest to całkowite przeciwieństwo cyrkonu, który choć chemicznie jest bardzo podobny do hafnu, jest bardzo słaby w absorbowaniu neutronów., Cyrkon jest zatem stosowany w okładzinie (zewnętrznej warstwie) prętów paliwowych, przez które ważne jest, aby neutrony mogły łatwo podróżować.
Hafn jest również stosowany w fotograficznych żarówkach błyskowych, żarówkach żarówek oraz w sprzęcie elektronicznym jako katody i kondensatory.
stopy hafnu z kilkoma innymi metalami, takimi jak żelazo, niob, tantal i tytan.
stopy hafnu-niobu, na przykład, są odporne na ciepło i są stosowane w zastosowaniach lotniczych, takich jak silniki rakietowe.,
węglik hafnu jest używany do linii wysokotemperaturowych pieców / pieców ze względu na swoje właściwości ogniotrwałe (nie topi się w wysokich temperaturach).
związki na bazie hafnu są stosowane w izolatorach bramkowych w układach scalonych do komputerów generacji 45 nm.
związki na bazie tlenku hafnu są wprowadzane do układów na bazie krzemu w celu produkcji mniejszych, bardziej energooszczędnych i wydajnych procesorów(4).
obfitość i izotopy
obfitość skorupy ziemskiej: 3,3 części na milion wagowo, 0.,4 części na milion moli
obfitość Układ Słoneczny: 1 część na miliard wagowo, 0,01 części na miliard moli
koszt, czysty: 120 USD za 100 g
koszt, luzem: $za 100 G
źródło: Hafn nie jest wolny w przyrodzie, ale znajduje się w większości minerałów cyrkonu w stężeniu od jednego do pięciu procent. Komercyjnie Hafn jest wytwarzany jako produkt uboczny rafinacji cyrkonu. Odbywa się to za pomocą procesu Krolla, redukując tetrachlorek magnezem lub sodem.,

- Zdjęcie Deglr6328
- na Enghag, encyklopedia elementów: Dane techniczne – Historia – przetwarzanie – Aplikacje, 2008, John Wiley&
- Bob Weintraub, George De Hevesy (1885-1966) (dokument pdf).
- Aile Tamm, Atomic Layer Deposition Of High-Permittivity Insulators From Cyclopentadienyl-Based Precursors, 2010, Tartu University Press, p18.,
Zacytuj tę stronę
w przypadku linkowania online skopiuj i wklej jeden z następujących elementów:
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium</a>
lub
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium Element Facts</a>
aby zacytować tę stronę w dokumencie akademickim, użyj następującego cytowania zgodnego z MLA:
"Hafnium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hafnium.html>.