wprowadzenie
Polycystic ovary syndrome (PCOS) jest jednym z najczęstszych zaburzeń endokrynologii u kobiet w wieku rozrodczym. PCOS jest diagnozowany przez potwierdzenie obecności dwóch z następujących: oligo-i/lub anovulacji, hiperandrogenizmu klinicznego i / lub biochemicznego oraz ultradźwiękowych cech policystycznych jajników, z wyłączeniem innych etiologii (Fr i Tarlatzis, 2004)., Częstość występowania PCOS zależy od zastosowanych kryteriów diagnostycznych, ale mogą one wynosić do 18% w przypadku stosowania kryteriów diagnostycznych Rotterdam (Rotterdam ESHRE / ASRM-Sponsored PCOS Consensus Workshop Group, 2004). Hiperandrogenizm występuje u 60-80% kobiet z PCOS (Azziz et al., 2006). Główne kliniczne lub biochemiczne cechy hiperandrogenizmu to trądzik, hirsutyzm, łysienie i łojotokowe zapalenie skóry; podwyższony poziom testosteronu, androstendionu i siarczanu dehydroepiandrosteronu; i zmniejszony poziom globuliny wiążącej hormony płciowe (SHBG)., Zespół nie tylko prezentuje się z objawami reprodukcyjnymi, ale także ma wpływ metaboliczne, w tym insulinooporność, dyslipidemia, otyłość, cukrzyca typu 2 i ogólnoustrojowe zapalenie (Deugarte et al., 2005; Sartor and Dickey, 2005; Escobar-Morreale et al., 2011).
podczas gdy leczenie pierwszego rzutu w indukcji owulacji u kobiet z PCOS polega na podawaniu cytrynianu klomifenu, uważa się, że antyestrogenne działanie cytrynianu klomifenu na śluzówkę endometrium i szyjki macicy powoduje niski współczynnik zapłodnienia wynoszący 20% (Gonen and Casper, 1990)., Cytrynian klomifenu jest również związany z szeregiem działań niepożądanych, w tym uderzeń gorąca, dyskomfortu piersi, wzdęcia brzucha, nudności, wymioty, nerwowość, bóle głowy, wypadanie włosów i zaburzenia widzenia (Legro et al., 2007a). Ostatnie badania badały rolę metforminy jako środka uczulającego na insulinę i chociaż jej stosowanie wzrasta, zrozumienie jej mechanizmu jest niekompletne (Legro et al., 2007b)., Ponadto może powodować rozwój wielu pęcherzyków, a także ryzyko hiperstymulacji jajników, ciąży mnogiej i wad wrodzonych, takich jak wady cewy nerwowej, co prowadzi do potencjalnie niezadowalających wyników leczenia.
ponieważ PCOS jest zdefiniowany jako wieloczynnikowe zaburzenia metaboliczno-endokrynologiczne (Laven et al., 2002), styl życia i dieta, a w szczególności dieta śródziemnomorska, odgrywają istotną rolę, obok leczenia farmakologicznego (Barrea et al., 2019)., Ostatnie badania sugerują, że komplementarne i alternatywne metody leczenia, w tym leki ziołowe i akupunktura, mogą złagodzić objawy PCOS, ale dowody ich skuteczności i bezpieczeństwa są niewystarczające. Dlatego w celu optymalizacji leczenia PCOS należy zbadać nowe strategie leczenia obejmujące terapie uzupełniające i alternatywne. W tym badaniu przeanalizowaliśmy dane dotyczące wpływu i mechanizmów leżących u podstaw leków ziołowych stosowanych w leczeniu modelu PCOS w badaniach laboratoryjnych.,
metody
artykuły opublikowane w języku angielskim do 30 czerwca 2018 r.były wyszukiwane w Medline (za pośrednictwem PubMed) i EMBASE (za pośrednictwem Elsevier). Wyszukiwane terminy były połączeniem terminów medical subject heading (MeSH) i ich synonimów. Szukane frazy: i .
kryteria włączenia naszego przeglądu obejmowały następujące elementy:
1. Badania in vitro i In vivo oceniające potencjalny wpływ leków ziołowych na model PCOS
2., Badania nad związkami wyizolowanymi z ziół, pojedynczych ekstraktów ziołowych lub wywarów ziołowych
3. Artykuły napisane w języku angielskim
kryteria wykluczenia były następujące:
1. Badania kliniczne leków ziołowych na PCOS
2. Artykuły przeglądowe
3., Artykuły, które nie opisywały składników ziołolecznictwa, jednak było to dozwolone w przypadku opatentowanych leków ziołowych
wśród pobranych badań, po usunięciu duplikatów, tytuły i abstrakty były przeglądane w celu znalezienia potencjalnie istotnych artykułów. Następnie Przejrzano pełne teksty sprawdzonych artykułów, aby potwierdzić, że spełniają one nasze kryteria włączenia.,
wyodrębniliśmy dane dotyczące interwencji ziołowej; cel cell cell (lub model zwierzęcy) wykorzystanie; metoda ekstrakcji ziołowej: droga podawania; Dawkowanie i okresy; i wyniki związków izolowanych z ziół, poszczególnych ekstraktów ziołowych i wywary ziołowe formuły. Na podstawie tych danych podsumowaliśmy działania i mechanizmy leżące u podstaw korzystnego wpływu leków ziołowych na model PCOS.
wyniki
charakterystyka badania
w niniejszym przeglądzie uwzględniliśmy łącznie 27 badań z udziałem 22 leków ziołowych, które zgłosiły ich skuteczność w modelu PCOS., Zidentyfikowaliśmy dwa badania in vitro, 22 badania in vivo i trzy badania zarówno z eksperymentów in vitro i In vivo. Interwencje ziołowe w 27 badaniach obejmowały cztery związki wyizolowane z ziół( 6 badań), dziewięć pojedynczych ekstraktów ziołowych (11 badań) i dziewięć wywarów ziołowych (10 badań). Schemat procesu wyboru artykułu przedstawiono na rysunku 1.
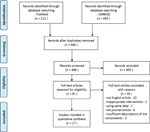
Rysunek 1 schemat procesu wyboru Badania.,
interwencje ziołowe i ich wyniki laboratoryjne
związki izolowane z ziół
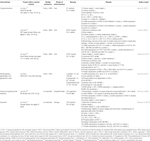
tabela 1 Badania in vitro i In vivo związków izolowanych z ziół (n=6).
poszczególne ekstrakty ziołowe
Aloe vera (L.) Burm.f. obniżony poziom cholesterolu całkowitego (TC), trójglicerydów (TG) i cholesterolu lipoprotein o niskiej gęstości (LDL-C); podwyższony poziom cholesterolu lipoprotein o wysokiej gęstości (HDL-C) (Desai et al.,, 2012); znormalizowany wzrost pęcherzyków; i odzyskał cykl Rui (Maharjan et al., 2010). Atractylodes macrocephala Koidz. wywołał odzyskiwanie cyklu rui i obniżenie poziomu testosteronu, poziomu androstendionu, wolnego indeksu androgenów, poziomów LH, stosunku LH / FSH i poziomów hormonów anty-Müllerowskich (Zhou et al., 2016). Matricaria chamomilla L.-leczonych samic szczurów Wistar wykazały zmniejszenie torbieli w tkance jajnika i zwiększoną liczbę pęcherzyków dominujących (zangeneh et al., 2010). Cocos nucifera L., odzyskał cykl Rui; obniżony poziom TC, cholesterolu o bardzo niskiej gęstości i TG; i zwiększone poziomy HDL-C (Soumya et al., 2014). U samic szczurów SD leczonych Linum usitatissimum L. stwierdzono zwiększenie pęcherzyków antralnych i ciałka żółtego, zmniejszenie liczby pęcherzyków torbielowych i zmniejszenie średnicy pęcherzyków antralnych (Jelodar et al., 2018). Foeniculum vulgare Mill. indukowane normalne kłębuszki, prawidłowa błona Piwniczna i naczynia włosowate (Sadrefozalayi i Farochi, 2014)., Zingiber officinale Roscoe obniżył poziom LH i estrogenu oraz zwiększył poziom FSH i progesteronu u noworodków samic szczurów SD (Atashpour et al., 2017). Żeń-szeń koreański czerwony (Panax ginseng C. A. Mey.u samic szczurów leczonych SD stwierdzono mniej pęcherzyków torbielowych i ekspresję mRNA NGF w jajnikach (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata zwiększa szybkość infuzji glukozy i obniża poziomy TC i TG (Mannerås et al., 2010). Dane podsumowano w tabeli 2.,
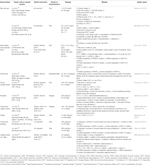
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Chińska medycyna ziołowa (MP) 1 (korzeń Astragali korzeń Ремании leki, cuscuta mi chińskich Lam, owoce mieszka Лучиди, owoce Psoraleae, korzeń korzeń Miltiorrhizae i maliny Lin) i 2 MP (cuscuta mi chińskich Lam, owoce mieszka Лучиди i maliny Lynn), wywołane przywracanie эстрального cyklu i LH/FSH stosunek, i zmniejszenie андростендиона muszą poziomów i wolny androgenne indeks (GU al., 2015)., Gui Zhu Yi kun formula (GZYKF) (Semen Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, adenophora tetraphylla, Plantago asiatica, Rubia cordifolia i Luffa cylindric) zmniejszyła ekspresję mRNA Beclin 1, light chain 3 i tumor supressor p53 (Xing et al., 2017). HemoHIM (Angelica Radix, Cnidia Rhizoma i Paeonia Radix) – leczonych samic szczurów SD wykazały zwiększoną liczbę i rozmiar ciałka żółtego i obniżony poziom białka NGF w jajnikach (Kim et al., 2009). Stwierdzono, że HEQI san zmniejsza poziom LH i testosteronu oraz łagodzi insulinooporność (Zhao et al., 2017)., Nowy lek ziołowy immunomodulator (iMod) (Rosa canina, Urtica dioica i Tanacetum vulgare)-leczone samice szczurów albino Wistar wykazywały mniejszą częstość występowania pęcherzyków atretic jajnika i torbieli oraz większą liczbę ciałek żółtych (Rezvanfar et al., 2012). Podawanie Kyung-Ok-Ko (KOK) spowodowało odzyskanie cyklu rui i klastra różnicowania (CD)11B, CD3, IL-1β, IL-6, TNF-α, IL-8, białko chemoatrakcyjne monocytów (MCP)-1 oraz zmniejszenie ekspresji mRNA Inos w jajnikach samic szczurów SD (Jang et al., 2014; Lee et al., 2016)., Samice szczurów SD leczonych Xiao-Yao-San (XYS) (radix bupleuri, angelica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, imbir, mięta i glycyrrhizae) wykazały zmniejszoną liczbę pęcherzyków torbielowych i obniżoną terminalną transferazę deoksynukleotydową dUTP nick End labeling (TUNEL) dodatnich komórek w pęcherzykach antralnych (Sun et al., 2017). Dane podsumowano w tabeli 3.

tabela 3 Badania in vitro i In vivo wywarów ziołowych formuł (n=10).,
działania leków ziołowych w leczeniu PCOS

Tabela 4 działania leków ziołowych w leczeniu PCOS.
mechanizmy działania PCOS

Tabela 5 mechanizmy działania leków ziołowych na PCOS.,
dyskusja
nasz przegląd literatury opublikowanej do 30 czerwca 2018 r.podsumował wyniki badań in vitro i In vivo dotyczących skuteczności leków ziołowych w leczeniu modelu PCOS. Stwierdzono, że w sumie cztery związki wyizolowane z ziół (6 badań), dziewięć pojedynczych ekstraktów ziołowych (11 badań) i dziewięć wywarów ziołowych (10 badań) mają działanie hamujące na PCOS., Według wyników zgłoszonych, leki ziołowe znormalizowały hormony żeńskie, zmniejszyły hormony męskie, odzyskały cykl Rui, poprawiły insulinooporność i poprawiły metabolizm lipidów. Odkryliśmy, że potencjalna aktywność hamująca leków ziołowych może wpływać na różne aspekty PCOS, z korzystnym działaniem leków ziołowych wynikającym głównie z działania przeciwzapalnego, stresu antyoksydacyjnego, hamowania autofagii lub apoptozy i redukcji NGF jajników.,
leki ziołowe mogą hamować stany zapalne PCOS
ostatnie badania wykazały etiologię i patologię PCOS. Naukowcy odkryli, że w mikrośrodowisku pacjentów z PCOS łagodne przewlekłe zapalenie jest cechą charakterystyczną zespołu (Nestler, 2000). PCOS ma znaczenie w przewlekłym zapaleniu (Benson et al., 2008), a makrofagi były jego główną patogenezą (Wu et al., 2004). Makrofagi jajników wytwarzają cytokiny, chemokiny i czynniki wzrostu zarówno w procesach normalnych, jak i zapalnych jajnika., Makrofagi mogą organizować apoptozę i przebudowę tkanek, które biorą udział w folikulogenezie, owulacji i tworzeniu ciałka żółtego (Benson et al., 2008). Biorąc pod uwagę krytyczną rolę makrofagów w PCOS (Benson et al., 2008), liczne badania porównywały stężenia cytokin w surowicy i w płynach pęcherzykowych u pacjentów z PCOS. Stężenia TNF-α i IL-6 w surowicy i płynach pęcherzykowych były podwyższone u pacjentów z PCOS bez otyłości i bez cukrzycy leczonych gonadotropinami (Amato i wsp., 2003)., Białko zapalne makrofagów-1α i MCP-1 były zwiększone u pacjentów z PCOS i związane z otyłością (Glintborg et al., 2009). Inos, cyklooksygenaza-2 (COX-2) i aktywność transformującego czynnika wzrostu (TGF)-β były zwiększone w jajnikach pacjentów z PCOS (Elia et al., 2006; Hatzirodos et al., 2011), a aktywność iNOS i COX-2 zapobiegała podawaniu metforminy (Elia et al., 2006). Wyniki te sugerują, że układ odpornościowy ma znaczenie dla patogenezy PCOS., Dlatego nowe środki zaradcze ukierunkowane na ten proces zapalny mogą być terapeutyczną alternatywą dla obecnego leczenia.
w tym przeglądzie irydoidy znacząco hamowały ekspresję IL-1β, IL-6, IL-10 i Inos, hamując w ten sposób stany zapalne (Zuo et al., 2017). Kwercetyna również znacząco obniżyła poziomy IL-1β, IL-6 i TNF-α i zmniejszyła translokację jądrową czynnika jądrowego kappa B (NF-kB)w insulinoopornym modelu szczura PCOS (Wang et al., 2017)., Przed podaniem KOK zmniejszyła się zwiększona ekspresja Zjonizowanej cząsteczki adaptera wiążącego wapń -1 ( + ) makrofagów w warstwie komórkowej torbieli i zromy. KOK zwiększał również ekspresję mRNA CD11b i CD3 w tkance jajnikowej PCOS. Przed podaniem KOK znacząco zmniejszał zwiększone poziomy IL-1β, IL-6, IL-8, TNF-α, MCP-1 i iNOS; oraz zwiększał zmniejszoną ekspresję mRNA naskórkowego czynnika wzrostu i TGF-β w jajnikach PCOS., Wyniki te wykazały, że KOK reguluje ekspresję mediatorów zapalnych w modelu PCOS indukowanym dehydroepiandrosteronem (DHEA) (Jang et al., 2014). Mediatory zapalne zostały również regulowane w endometrium macicy przez podawanie Koka, co wykazano, że zapobiega rozrostowi endometrium w modelach PCOS (Lee et al., 2016). Wykazano również, że TNF-α w surowicy i prostaglandyny E (PGE) w jajniku zostały zmniejszone przez IMODs (Rezvanfar et al., 2012).,
leki ziołowe mogą złagodzić stres oksydacyjny w PCOS
reaktywne formy tlenu są ważnymi cząsteczkami sygnałowymi w regulacji funkcji fizjologicznych w reprodukcji kobiet, w tym steroidogenezy, folikulogenezy, dojrzewania oocytów, funkcji ciałka żółtego i luteolizy (Agarwal et al., 2005). Ponadto odgrywają kluczową rolę w patologicznych procesach reprodukcji kobiet (Agarwal et al., 2003; Agarwal i in., 2008)., Stres oksydacyjny jest stanem, w którym równowaga między zdolnością antyoksydacyjną organizmu a toksycznymi produktami pochodzenia tlenowego i/lub azotowego jest zaburzona. W związku z tym wolne rodniki są niedostatecznie odtruwane przez przeciwutleniacze komórkowe. Stres oksydacyjny odgrywa ważną rolę w reprodukcji kobiet (Ruder et al., 2008; Ruder i in., 2009; Vakilian et al., 2009), i jest coraz więcej literatury na temat wpływu zwiększonych markerów stresu oksydacyjnego u niepłodnych kobiet, i na ich udział w patofizjologii PCOS (Joo et al., 2010; Mohamadin i in., 2010)., PCOS charakteryzuje się przewlekłym zapaleniem, stresem oksydacyjnym i nieprawidłową ekspresją mikroRNA (Zhao et al., 2015; Zuo et al., 2016). Ponieważ wiadomo, że stan zapalny i stres oksydacyjny są ściśle powiązane, podwyższony stres oksydacyjny zwykle wynika i prowadzi do stanu zapalnego (Zuo et al., 2016). Trudno jest oddzielić stan zapalny od stresu oksydacyjnego, a w ostatnich latach zaproponowano, że stan zapalny i stres oksydacyjny stanowią główną podstawę występowania choroby (Duleba and Dokras, 2012).
w tej recenzji IMODs (Rezvanfar et al.,, 2012) i irydoidy (Zuo et al., 2017) wykazały pozytywny wpływ na stres oksydacyjny / nitrozacyjny, bezpośrednio lub pośrednio, głównie poprzez redukcję wolnych rodników i hamowanie cytokin zapalnych u szczurów PCOS. Podawanie Imodów znacznie zmniejszyło peroksydację lipidów (marker stresu oksydacyjnego) i zwiększyło poziomy dysmutazy ponadtlenkowej, katalazy i peroksydazy glutationowej (markery potencjału przeciwutleniającego) w PCOS wywołanym hiperandrogenizmem. Ponadto poziomy nadtlenoazotanu (markera stresu nitrozacyjnego), TNF-α i PGE zostały znacznie zmniejszone przez iMod., Ponadto, te efekty stosowania iMod były zgodne z danymi histologicznymi, które wykazały znaczącą poprawę mikroskopowych cech folikulogenezy w porównaniu z tymi w grupie kontrolnej (Rezvanfar et al., 2012). System sygnalizacji NF-kB jest znany jako dominujący paradygmat dla określonych cząsteczek transdukcji sygnału, aktywacji genów i białek regulacyjnych w odpowiedzi na zapalenie (Ivanenkov et al., 2011)., Irydoidy skutecznie osłabiły lipopolisacharyd wywołany podwyższeniem poziomu fosforylacji IkB, obniżeniem poziomu ekspresji IkB i obniżeniem NF-kB P65, co wskazuje,że irydoidy wywierają swoje działanie przeciwutleniające za pośrednictwem szlaku NF-kB (Zuo et al., 2017).
leki ziołowe mogą regulować apoptozę i/lub autofagię w PCOS
przeżycie lub śmierć komórek ziarniniaków jest uznawany za krytyczny czynnik wpływający na los pęcherzyków (Matsuda et al., 2012). Apoptoza i autofagia to dwie formy zaprogramowanej śmierci komórki., Autofagia jest procesem, w którym autofagosom, który jest pęcherzykiem dwu błonowym, przenosi materiał cytoplazmatyczny do lizosomu (Mizushima i Komatsu, 2011). Stwierdzono, że zarówno apoptoza, jak i autofagia mogą być indukowane w komórkach ziarnistych i że biorą udział w kontroli rozwoju pęcherzyków (Choi et al., 2010; Choi et al., 2013). Komórki ziarniniakowe są rozpoznawane jako kluczowe podmioty w rozwoju pęcherzyków. Wytwarzają estradiol, insulinopodobne czynniki wzrostu i inne cytokiny w jajniku i ekspresują receptory dla estradiolu, LH i FSH (Juengel et al.,, 2006), z których wszystkie uczestniczą w regulacji rozwoju pęcherzyków. Tak więc, wszelkie zaburzenia komórek ziarnistych może prowadzić do nieuporządkowanego rozwoju pęcherzyków.
w ostatniej dekadzie zidentyfikowano szlaki sygnałowe związane z autofagią i ich główne regulatory białkowe. Białko związane z mikrotubulami szczura 1 łańcuch lekki 3 jest związane z przetwarzaniem błony autofagosomu (Kabeya et al., 2000). Wykazano również, że Beclin-1 odgrywa kluczową rolę w tworzeniu autofagosomów (Von Hoven et al., 2012)., Ponadto, poprzednie badania zidentyfikowały supresor guza p53 (p53)jako podwójny modulator autofagii w regulacji śmierci lub przeżycia komórek (Vousden and Ryan, 2009; Zhang et al., 2010). Przy niskim poziomie energii, kinaza białkowa aktywowana przez monofosforan adenozyny (AMPK), która jest aktywowana przez p53, jest w stanie aktywować kompleks stwardnienia guzowatego 2, a tym samym hamować aktywność rapamycyny (mTOR) u ssaków i zwiększać autofagię (Feng et al., 2007)., W tym przeglądzie p53, który jest aktywowany przez gzykf w jądrze, z kolei aktywuje AMPK i sestrynę, działając jako sprzężenie zwrotne w hamowaniu mTOR, aktywując w ten sposób autofagię. Autofagia jest również modulowana przez ścieżki sygnałowe fosfoinozytydu 3-kinazy/kinazy białkowej B (PI3K/Akt) (Pyo et al., 2012). W tym przeglądzie XYS złagodził redukcję fosforylacji polipeptydu kinazy S6 kinazy rybosomalnej i I Akt, a także wzrost konwersji łańcucha świetlnego białka związanego z mikrotubulami 3 – I do konwersji łańcucha świetlnego białka związanego z mikrotubulami 3-II ZARÓWNO in vivo, jak i in vitro (Sun et al., 2017).,
endometria u większości pacjentów z PCOS jest gęsta i wykazuje prosty, skomplikowany lub nietypowy rozrost lub złośliwą transformację, która może być skorelowana z apoptozą komórek endometrium (Villavicencio et al., 2007). Hiperandrogenizm wywołany przez DHEA jest związany z większą liczbą komórek apoptotycznych w endometrii, a metformina (środek insulinomimetyczny lub uczulający na insulinę) jest w stanie zmniejszyć zwiększoną liczbę komórek apoptotycznych (Elia et al., 2009). W tym przeglądzie oceniano apoptotyczną śmierć komórek poprzez barwienie TUNELA., Komórki apoptotyczne były rzadko wykrywane przez barwienie tunelowe w tkance macicy w grupie pozorowanej lub samej KOK. Zwiększono jednak liczbę komórek TUNELOWO-dodatnich w endometrii grupy DHEA. Zwiększona liczba komórek apoptotycznych została znacząco zmniejszona po podaniu KOK. Wyniki te wskazują, że przed podaniem KOK hamowało deformację endometrium wywołaną przez DHEA poprzez zmniejszenie apoptozy endometrium (Lee et al., 2016).,
leki ziołowe mogą obniżać poziom NGF w PCOS
poprzednie badania wykazały, że PCOS jest związany z nieprawidłową aktywacją współczulnego układu nerwowego, co powoduje wzrost nerwów katecholaminergicznych (Semenova, 1969), zaburzenia metabolizmu noradrenaliny (Garcia-Rudaz et al., 1998) i zwiększoną aktywność nerwów współczulnych przez nerw jajnikowy górny (Lara et al., 1993)., Rozwój i funkcja unerwienia współczulnego jajnika zależą od jajnika do produkcji NGF, neurotrofiny pochodzącej od celu wymaganej do rozwoju obwodowego układu współczulnego (Levi-Montalcini, 1987). Rodzina neurotrofin, implikuje receptor NGF i mRNA NGF w owulacji i w patofizjologii PCOS (Lara et al., 2000; Stener-Victorin et al., 2003). W jajnikach szczurów, NGF jest głównie syntetyzowany w komórkach ściany pęcherzyka (Dissen et al.,, 1996), a w PCOS aktywacja NGF może być czynnikiem zaangażowanym w zwiększenie odpływu noradrenaliny do gruczołu, który jest indukowany przez walerianian estradiolu (EV) (Lara et al., 2000) PCOS wykazuje wysoką wewnątrznowariańską gęstość włókien nerwowych, która jest związana z hiperresponsyjnością współczulną (Stener-Victorin et al., 2003).
w tej recenzji podawanie ziołowych formuł Changbudodam-Tang i Yongdamsagan-Tang znacznie zmniejszyło podwyższony NGF w jajnikach z niewielkim wpływem na tkankę mózgową (Lee et al., 2003)., HemoHIM znormalizował również NGF, obniżył wysoką liczbę pęcherzyków antralnych i zwiększył liczbę ciałek żółtych w PCOS. Wyniki te są zgodne z wynikami poprzednich badań nad korzystnym wpływem HemoHIM w zapobieganiu i leczeniu PCOS (Pak et al., 2009). Ponadto administracja koreański czerwony ekstrakt żeń-szenia (Pak et al., 2009; Jung et al., 2011) i koreański czerwony żeń-szeń razem saponiny (Pak et al., 2005) znacznie zmniejszyła ekspresję białka NGF i mRNA NGF, w porównaniu z tymi występującymi w jajnikach leczonych EV.,
w badaniu dokonano przeglądu danych dotyczących leków ziołowych, które mogą być stosowane w leczeniu PCOS i związanych z nimi objawów, a wyniki mają na celu zwiększenie zrozumienia przez lekarzy mechanizmów działania leków ziołowych w leczeniu PCOS. Głównym ograniczeniem naszego badania jest niejednorodność interwencji. Ponadto w naszym badaniu nie przeprowadzono oceny jakości każdego badania ani ilościowej syntezy wyników. Uzasadnione są dalsze badania, które obejmują metodologiczną ocenę jakości i ilościową syntezę wyników.,
wnioski
w tym przeglądzie w sumie 27 badań z udziałem 22 leków ziołowych wykazywało korzystny wpływ na PCOS. Interwencje ziołowe w 27 badaniach obejmowały cztery związki wyizolowane z ziół( 6 badań), dziewięć pojedynczych ekstraktów ziołowych (11 badań) i dziewięć wywarów ziołowych (10 badań). Wykazano, że leki ziołowe normalizują żeńskie hormony, zmniejszają męskie hormony, odzyskują cykl Rui, poprawiają insulinooporność i poprawiają metabolizm lipidów w PCOS., Mechanizmy leżące u podstaw korzystnego wpływu leków ziołowych na PCOS są związane z działaniem przeciwzapalnym, stresem antyoksydacyjnym, hamowaniem autofagii i (lub) apoptozy oraz redukcją NGF jajników. Leki ziołowe można uznać za obiecujące zasoby w rozwoju skutecznych środków terapeutycznych dla PCOS.
wkład autora
i-HC i KP zaprojektowały opracowanie. C-YK i KP przeszukali artykuły i przeanalizowali dane. KP napisał manuskrypt, a i-HC poprawiło go. Wszyscy autorzy przyczynili się do powstania artykułu i zatwierdzili nadesłaną wersję.,
finansowanie
praca ta była wspierana przez National Research Foundation of Korea (NRF) grant finansowany przez rząd Korei (MSIP) (No.NRF-2017r1c1b1006387) i koreańskie Towarzystwo żeń-szenia (2019).
konflikt interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystyc ovary syndrome. Bezpłodność 81 (1), 19-25. podoba mi się! do obserwowanych nr: 601662003.10.004
CrossRef Full Text | Google Scholar
Semenova, I. (1969). Unerwienie adrenergiczne jajników w zespole Steina-Leventhala. Vestnik Akademii Meditsinskikh Nauk SSSR 24 (9), 58.
Google Scholar