katalizator jest substancją, która przyspiesza reakcję chemiczną, ale nie jest zużywana przez reakcję; w związku z tym katalizator może być odzyskiwany chemicznie w niezmienionej postaci pod koniec reakcji został użyty do przyspieszenia, lub katalizować.

dyskusja
aby chemikalia mogły reagować, ich wiązania muszą zostać zmienione, ponieważ wiązania w produktach różnią się od tych w reagentach.,Najwolniejszy krok w przegrupowaniu wiązania wytwarza to, co nazywa się stanem przejściowym – gatunek chemiczny, który nie jest ani reagentem, ani produktem, ale jest pośrednim między nimi.
energia jest wymagana do utworzenia stanu przejścia. Energia ta nazywana jest energią aktywacji lub EA.Czytanie poniższego diagramu od lewej do prawej pokazuje postęp reakcji, jak reagenty przechodzą przez stan przejściowy, aby stać się produktami.,
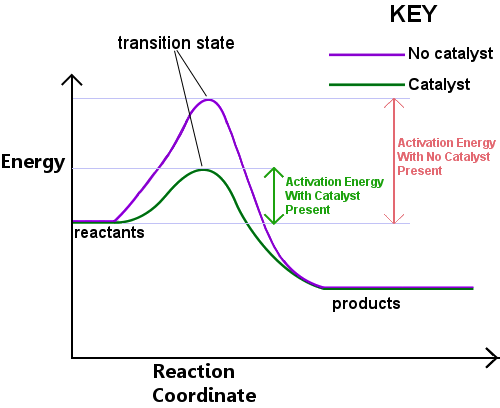
energia aktywacji może być uważana za barierę dla reakcji chemicznej, przeszkodę, która musi zostać przekroczona.Jeśli bariera jest wysoka, niewiele cząsteczek ma wystarczającą energię kinetyczną, aby zderzyć się, utworzyć stan przejściowy i przekroczyć barierę.Reagenty o energii niższej niż Ea nie mogą przejść przez stan przejściowy, aby reagować i stać się produktami.
katalizator działa poprzez dostarczenie innej drogi, z niższym Ea, dla reakcji. Katalizatory obniżają barierę energetyczną.,Inna droga pozwala na łatwiejsze przestawianie wiązań potrzebnych do konwersji reagentów na produkty, przy niższej energii input.In każdy dany przedział czasu, obecność katalizatora pozwala większą część reagujących gatunków, aby zebrać wystarczającą energię, aby przejść przez stan przejściowy i stać się produktami.
przykład 1: Proces Habera
proces Habera, który jest używany do wytwarzania amoniaku z wodoru i azotu, jest katalizowany przez żelazo, które zapewnia miejsca atomowe, na których reagent może łatwiej zmienić układ, tworząc stan przejściowy.,
przykład 2: enzymy
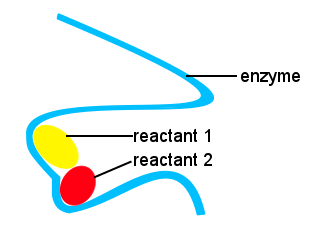
w naszych ciałach i w innych żywych organizmach enzymy są używane do przyspieszenia reakcji biochemicznych. Enzym jest rodzajem katalizatora.Złożone życie byłoby niemożliwe bez enzymów, aby umożliwić reakcje zachodzą z odpowiednią prędkością.Kształty enzymów wraz z lokalizacjami na enzymie, które wiążą się z reaktantami, zapewniają alternatywną ścieżkę reakcji, pozwalając określonym cząsteczkom połączyć się w celu utworzenia stanu przejściowego o zmniejszonej barierze energii aktywacji.,
na poniższym schemacie enzym o długim łańcuchu zapewnia miejsca, w których reagujące cząsteczki łączą się, tworząc stan przejściowy o niskiej energii aktywacji.
katalizatory nie mogą przesunąć położenia równowagi chemicznej – reakcje do przodu i do tyłu są przyspieszane tak, że stała równowagi Keq pozostaje niezmieniona.Jednak poprzez usunięcie produktów z mieszaniny reakcyjnej w miarę ich tworzenia, ogólny wskaźnik tworzenia produktu może być w praktyce zwiększony.