wprowadzenie
zespół Klippel-Trénaunay-Weber (KTWS) charakteryzuje się zestawem objawów, które składają się z wad rozwojowych naczyń włosowatych, wad żylnych z lub bez limfatycznych wady rozwojowe związane z przerostem Kończyn1. W większości przypadków dotyczy tylko jednej kończyny z wadami tętniczo-żylnymi i około 75% pacjentów manifestuje chorobę przed 10 latem2, 3.,
zespół Klippela-Trenaunaya został po raz pierwszy opisany przez Maurice ' a Klippela i Paula Trenaunaya. Zgłoszono dwa przypadki, w których wspólna była Triada (plama po Porto, żylaki oraz przerost kości i tkanek miękkich) 4. Jakiś czas później Frederick Weber opisał niektóre przypadki wykazujące podobieństwo do triady, z obecnością przetoki tętniczo-żylnej jako skojarzenia3,4. SKTW i zespół Parkesa Webera mogą być rozpatrywane razem jako Klippel-Trenaunay-Weber sd, ponieważ wykazują one różne objawy kliniczne pojedynczej chorobi5, 6.,
KTWS jest rzadkim wrodzonym zaburzeniem mezodermalnym, z około 1000 przypadków zarejestrowanych na całym światu7. KTWS jest równomiernie rozłożony wśród różnych grup etnicznych i dotyka większej liczby mężczyzn, w stosunku 1,5:17,8. Etiologia tego zespołu pozostaje nieznana, chociaż istnieją pewne teorie na temat jego patogenów9.
chociaż KTWS jest sporadycznym stanem, badania donoszą o rodzinnych przypadkach KTWS, które nie zostały odziedziczone poprzez wzór Mendla, co sugeruje dziedziczenie wieloczynnikowe, ze zmienną penetracją i ekspresją., Późniejsze badania przeprowadzone przez Happle sugerują, że dziedziczenie pojedynczego wadliwego genu nabytego podczas embriogenezy może wyjaśniać rozwój tego zespołu, a także występowanie sporadycznych i rodzinnych przypadków, co sugeruje, że dziedziczenie autosomalne dominujące jest najbardziej prawdopodobne10,11.
klinicznie, KTWS obejmuje naczyniak płaski, zmiany żylne, takie jak wady rozwojowe i żylaki, przerost kości i tkanek miękkich. 12,13
diagnoza ma charakter kliniczny i może być wykonana przez obecność triady nieprawidłowości lub tylko dwóch objawów triady.,
zazwyczaj pacjenci z Plamami Porto od urodzenia, głównie w przerośniętych kończynach, różniących się głębokością14. Wady rozwojowe żylne dotyczą kończyn dolnych w zdecydowanej większości przypadków. Angiodysplazja tętnicza lub żylna może być obecna w każdym regionie ciała, od skóry do narządów trzewnych. Dlatego istnieje możliwość zapalenia żył, krwawienia, zakrzepicy żył głębokich, zatorowości płucnej, hemoperytneum, krwiak opłucnej i przewlekłej niewydolności żylnej15.
jest to zespół rzadki, ale zasługuje na podkreślenie ze względu na postępującą i ciężką chorobowość.,
opis przypadku
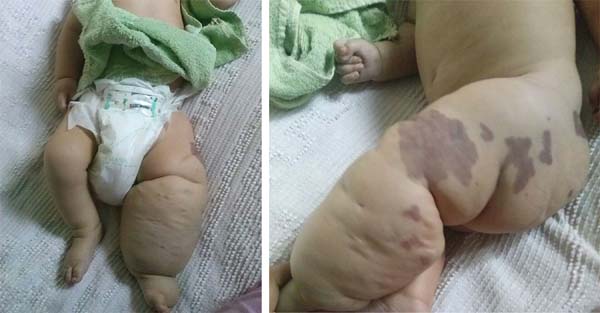
D. A. P., 7-miesięczny mężczyzna, urodzony i zamieszkały w Anápolis-GO, został przekazany do naszego serwisu w izbie przyjęć Hospital de Clínicas, Federalny Uniwersytet Uberlândia, MG, dnia 29/12/2014 z gorączką, wymiotami, biegunką i odwodnieniem przez 2 dni. Wraz z tą prezentacją przedstawił gigantyczny naczyniak lewej kończyny dolnej, żylaki i przerost kości i tkanek miękkich (KTWS) (ryc. 1) z historią niedawnego leczenia laserowego w innym serwisie Goiânia-GO i z propranololem.,

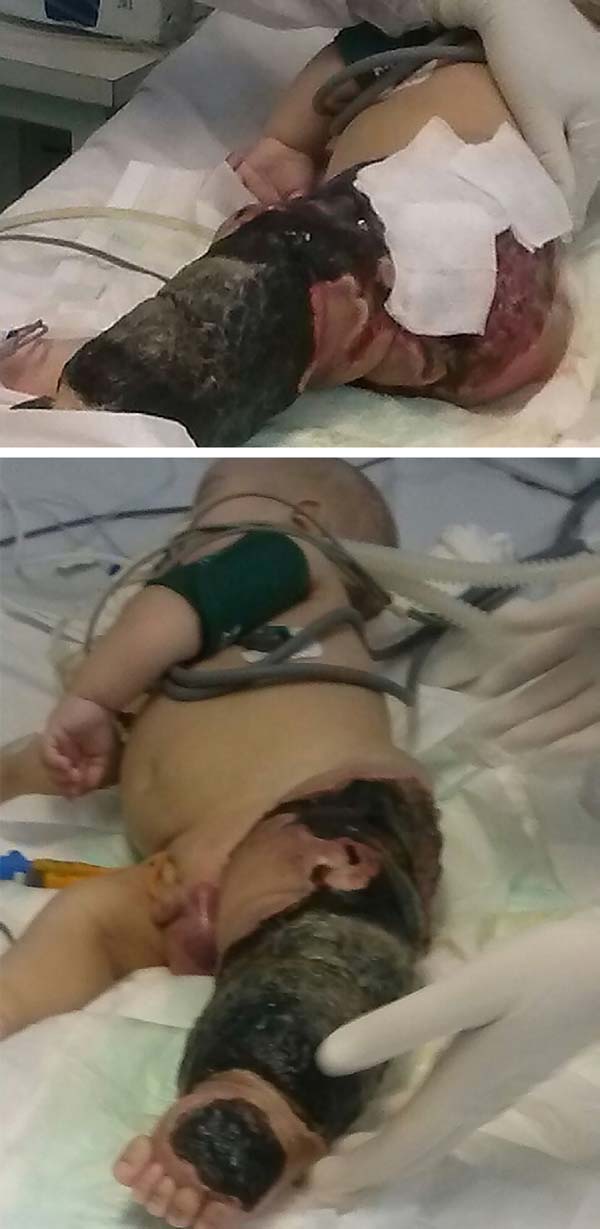
u pacjenta doszło do szybkiego i ciężkiego postępu z martwicą lewej kończyny dolnej (LLL) aż do okolic pośladka i opornym wstrząsem septycznym (ryc. 2). Przez 28 dni był intensywnie leczony lekami wazopresorowymi i antybiotykoterapią o szerokim spektrum działania. Echo tętniczo-żylne wykonano podczas oceny operacji naczyniowych, potwierdzając rozpoznanie zespołu Klippela-Trénaunaya-Webera oraz identyfikując malformacje tętniczo-żylne i małe przetoki lewej kończyny., Pozostała jednak rozległa zmiana martwicza w LLL, wymagająca przede wszystkim chirurgicznego oczyszczenia LLL, a następnie rozwarstwienia lewego biodra z kolostomią ochronną w dniu 28.01.2015.
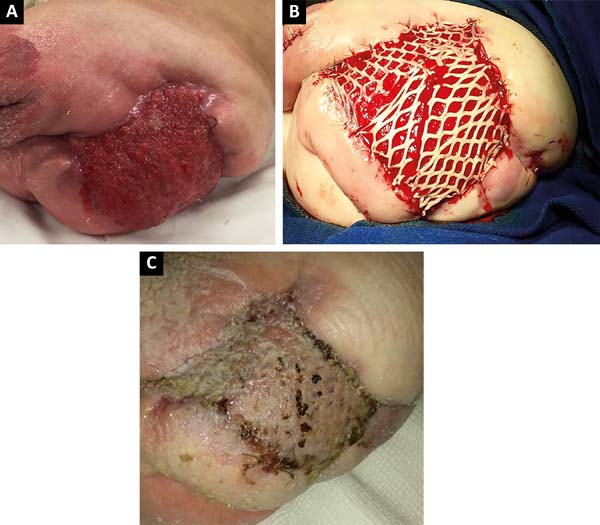
Po 2 miesiącach intensywnego leczenia klinicznego, kliniczną i miejscową poprawę zmiany obserwowano w obszarze pooperacyjnym rozszczepu (ryc. 3A), a przeszczep skóry wykonywano za pomocą elektrycznego dermatomu i przeszczepu Zacierowego w celu zatkania krwawej rany( ryc. 3b), z obszarem dawcy prawego uda. Pacjent wykazywał dobrą rekonwalescencję kliniczną i nabłonkowość obszaru biorcy i dawcy, wypisywany w 15. dniu pooperacyjnym (ryc. 3C).,
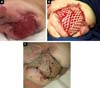
pacjent był w ambulatoryjnej obserwacji w tej usłudze, postępując zadowalająco z całkowitą epitelializacją obszarów dawcy i biorcy. Kolostomia ochronna została zamknięta wraz z rekonstrukcją TRANZYTU jelitowego.
dyskusja
, Takie postępowanie utrzymywało chorego w stanie niedyspozycji, cierpiącego na objawy przewlekłej zastoju żylnego i rozwijającego się z powikłaniami miejscowego zakażenia skóry aż do otrzymania ostatecznego leczenia.
nie ma leczenia leczniczego, a cele terapeutyczne mają na celu poprawę objawów pacjenta i korygowanie skutków poważnych urazów i rozbieżności długości. Jednak wszyscy autorzy zgadzają się, że konserwatywne środki nadal kierują leczeniem KTWS. Nie wyklucza to konieczności terminowych interwencji chirurgicznych podczas ewolucji Historii Naturalnej choroby.,
terapie Adiuwantowe mogą różnić się od terapii laserowej, z skleroterapią microfoam, etapami resekcji żył ektatycznych i nawet większymi ekscesami1,16-19 . Najczęściej stosowanymi wskazaniami do leczenia chirurgicznego są: krwotok, miejscowe zakażenia, choroba zakrzepowo-zatorowa oraz występowanie bardzo opornych na leczenie owrzodzeń nóg. Inne wskazania to: miejscowy ból, ograniczenia funkcjonalne i estetyczne17.
radioterapia interwencyjna odgrywa główną rolę w propedeutyce wad rozwojowych tętniczo-żylnych (AVMs)., Za jego pomocą można ocenić rodzaj malformacji i sposób budowy naczyń zasilających. W leczeniu AVM o niskim przepływie (KTWS), w niektórych przypadkach można zastosować wstrzyknięcie środka stwardniającego, aby zmniejszyć naczynia.
w innych przypadkach można to zrobić za pomocą fluoroskopii. Istnieją ograniczone możliwości leczenia wrodzonej dysplazji żylnej. W ciężkich przypadkach interwencjonista może użyć chirurgicznego usunięcia, skleroterapii lub techniki ablacji wewnątrznaczyniowej. Jeśli występują objawy na skórze, takie jak plamy po Porto, może być wskazane leczenie laserowe.,
w przypadkach takich jak opisany, biorąc pod uwagę wykonywany zabieg, obszar objęty szczepieniem może być postrzegany jako dobra opcja rekonstrukcyjna, biorąc pod uwagę prostotę zabiegu, mniejszą zachorowalność w porównaniu do stosowania klap i możliwość rehabilitacji poprzez zastosowanie protez.,
pomimo tego, że jest to najwyższy poziom amputacji kończyny dolnej, proteza jest wydajna, ponieważ proteza dla tego poziomu amputacji zapewnia bezpieczeństwo i stabilność, z ciągłym chodem, z lub bez pomocy ruchowej, w zależności od innych czynników, w tym wieku pacjenta.
KTWS należy podejrzewać u wszystkich noworodków z wadami naczyń włosowatych obejmującymi jedną kończynę ciała od urodzenia. Diagnostyka różnicowa KTWS obejmuje zespół Proteusa i zespół Maffucciego, a także inne nie syndromiczne wady rozwojowe naczyń włosowych20.,
duże postępy zostaną poczynione, gdy możliwe będzie jeszcze wczesne zdiagnozowanie KTWS i zapobieganie rozwojowi przerostu tkanek, złożonych angiodysplazji i innych zmian fenotypowych, być może poprzez skorygowanie lub zapobieganie powiązanej mutacji genetycznej20.
KTWS jest rzadką chorobą, o postępującej i ciężkiej chorobowości. Pacjent z tym zespołem musi towarzyszyć w centrum referencyjnym z doświadczeniem i różnorodnym arsenałem terapeutycznym, aby działać w najlepszy możliwy sposób w leczeniu., Każdy pacjent ma parsymonię i indywidualizację w wyborze najlepszego leczenia, a także idealny czas, aby to osiągnąć.
obecnie wskazania do interwencji chirurgicznej są ograniczone do powikłań wynikających z wstępnej prezentacji. W tym przypadku zastosowanie leczenia chirurgicznego było kluczowe, aby umożliwić poprawę stanu klinicznego i jakości życia pacjenta, pokazując, że może to być ważna alternatywa.,
|
VPB |
pisanie manuskryptu lub krytyczna recenzja jego treści. |
|
AOM |
Analiza i / lub interpretacja danych; pisanie rękopisu lub krytyczny przegląd jego treści. |
2. Favorito LA. Naczyniak pęcherzowy u pacjenta z zespołem Klippela-Trenaunaya-Webera. J Urol. 2003;29(2):149-50.
4. Klippel M, Trénaunay P. Du NAEVUS variqueux osteohypertrophique. Arch Gen Med (Paryż)., 1900;185:641-72.
5. Weber FP. Haemangiectatic hypertrophy of limbs: wrodzona phlebarteriectasis and so-called wrodzona varicose veins. Br J Dis Child. 1918;15:13-7.
9. Meine JG, Schwartz RA, Janniger CK. Klippel-Trenaunay-Weber syndrome. Skóra. 1997;60(3):127-32. PMID: 9314616
1. Universidade Federal de Uberlândia, Uberlândia, MG, Brazil.
Institution: Universidade Federal de Uberlândia, Uberlândia, MG, Brazil.