Termodynamikk er en gren av physicswhich avtaler med energi og arbeid i et system.Termodynamikk tilbud bare med thelarge skala responseof et system som vi kan observeand mål i eksperimenter. Liten skala gass vekselsvirkningene aredescribed av kinetisk teori av gasser.Det er tre principallaws av termodynamikk som er beskrevet på egne sider., Eachlaw fører til definisjonen ofthermodynamic propertieswhich hjelpe oss til å forstå og forutsi drift av en physicalsystem. Vi vil presentere noen enkle eksempler på disse lover andproperties for en rekke av fysiske systemer, althoughwe er mest interessert i termodynamikk ofpropulsion systemsandhigh hastighet flyter.Heldigvis, mange av theclassical eksempler på termodynamikk innebære gass dynamics.,
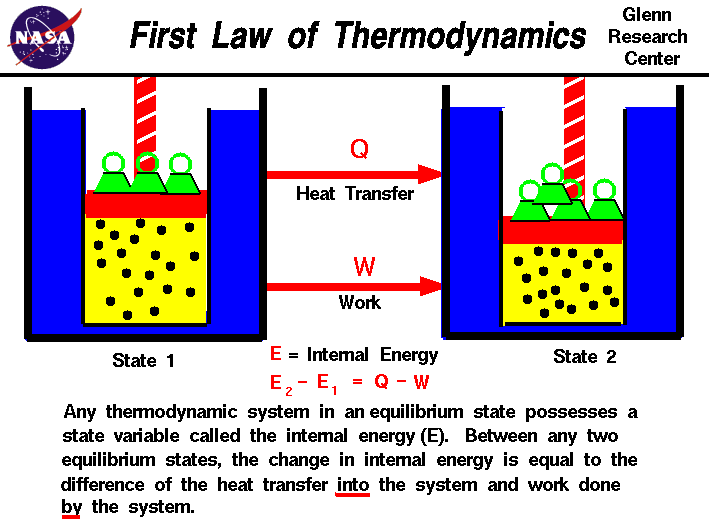
I våre observasjoner av arbeidet som er utført på,eller av en gass, har vi funnet at mengden av arbeid avhenger ikke onlyon første og siste landene i den gasbut også på prosessen, eller stien som produserer den endelige tilstand.Tilsvarende den mengden med varme som overføres til, orfrom en gass avhenger også av første og siste stater og theprocess som produserer den endelige tilstand., Mange observasjoner av realgases har vist at forskjellen i varmen strømme inn i gasand arbeid utført av gass avhenger bare på den første og finalstates av gass, og ikke avhengig av den prosessen eller pathwhich produserer den endelige tilstand. Dette tyder på eksistensen av anadditional variabel, kalles den indre energien i gassen,som bare avhenger av tilstanden til gassen og ikke på en hvilken som helst prosess.Indre energi er en tilstand variabel, akkurat som temperatur eller press., Den første lov i termodynamikken definerer internalenergy (E) som er lik forskjellen på å overføre varme (Q) intoa system og arbeid (W) utført av systemet.
E2 – E1 = Q – W
Vi har lagt vekt thewords «inn» og «av» i definisjonen. Varme fjernes fra en systemwould bli tildelt et negativt fortegn i ligningen. På samme måte workdone på system er tilordnet et negativt fortegn.,
Det indre energi er bare en form for energi som potentialenergy av et objekt på noen høyde over jorden, eller kineticenergy av et objekt i bevegelse. På samme måte som potensielle energycan bli omgjort til kinetisk energi samtidig bevare den totale energyof systemet, den indre energien til et termodynamisk system kan beconverted å enten kinetisk og potensiell energi. Som potentialenergy, den indre energien kan lagres i systemet.Men legg merke til at varme andwork kan ikke lagres eller konservert uavhengig av hverandre siden de dependon prosessen., Den første lov i termodynamikken gir mulighet for manypossible tilstander av et system for å eksistere, men bare visse stater arefound å finnes i naturen. Thesecond lawof termodynamikk hjelper toexplain denne observasjonen.
Hvis et system er fullstendig isolert fra det ytre miljøet, det ispossible å ha en endring av staten der ingen varme overføres til thesystem. Forskere refererer til en prosess som involverer ikke heattransfer som en adiabatic prosessen.,Gjennomføring av den første loven om termodynamikk for gasser introduserer anotheruseful staten variabel kalt enthalpywhich er beskrevet på en egen side.
Aktiviteter:
Guidede Turer
-
 Termodynamikk:
Termodynamikk: 
Navigering ..
![]()
![]()
![]()
Beginner ‘ s Guide hjemmesiden