készségek fejlesztése
- megérteni, hogy miért Lavoisier néha az úgynevezett “Az apa a Modern kémia”
- megkülönböztetni pontosság
Tehát mi történt, hogy kapcsolja alkímia, ami olyan volt, mint a mágikus főzet-sör a Harry Potter, a A kémia tudománya? Mérés volt. A mennyiségek gondos, gondos mérése, például tömegek, térfogatok, sűrűségek, hőmérsékletek, nyomás.
A mérés korai hőse Antoine Lavoisier volt., Ő volt az egyik első igazi kémiai tudós. Gondos kísérleteket végzett, és nem próbált következtetéseket levonni, kivéve azokat, amelyeket az adatai megköveteltek. Azt mondta, tény, gondolat, s a szó olyan szorosan összefügg, mivel lehetséges: hogy nem lehet javítani a nyelv nélkül javítani a dolgon, nem lehet javítani a gondolkodás nélkül javítja a nyelv. Tehát úttörő szerepet játszott egy szisztematikus kémiai nómenklatúrában, amelyet alapvetően ma használunk., Figyelemre méltó, hogy ha elolvassa az 1789-ben írt szövegét, amelynek célja a kémia bevezetése a kezdőknek, annak nagy része még mindig teljesen érthető, sőt a modern szabványok szerint is helyes.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier először az anyagállapotokat írja le: gázok, folyadékok és szilárd anyagok. Rámutat arra, hogy amikor egy szilárd anyagot melegítenek, hajlamos kibővülni, először folyadékká válik, amely állandó térfogatot vesz fel, de önthető, ellentétben a szilárd anyaggal., Több fűtés, és ez lesz a gáz, amely leírja, mint rugalmas, mert bővíteni vagy tömöríteni a különböző térfogatú, attól függően, hogy a nyomás. A görög filozófusokkal ellentétben megértette, hogy ez egy fizikai változás, nem pedig kémiai változás, és jó szubmikroszkópiás intuícióval rendelkezik arról, hogy mi történik: az anyag részecskéi nem változnak, csak távolabb kerülnek egymástól.,
ként, foszfort és faszenet (szén) égetett, és gondos megfigyeléseket tett, gyakran a csengőedényt egy vödör higany felett használva, amint az a könyvének 1. ábráján látható. Ez egy példa egy kémiai változásra vagy kémiai reakcióra, amelyben a reagens vegyi anyagok különböző termék vegyi anyagokká alakulnak. Ha a D jelzésű edényben a ként a levegő csengőedénye alatt világítja meg, addig ég, amíg ki nem megy, így extra ként hagy. Az üvegben maradt levegő már nem jó a légzéshez. Ha egeret tesz az edénybe, akkor meghal, csakúgy, mint a láng., Ez bemutatja a reagens korlátozásának fogalmát. A reakció vagy égő megállt, amikor elfogyott az oxigén, így elsősorban nitrogén (és néhány nyom más gázok) a jar. Priestley, egy másik tudós, megmutatta neki, hogyan kell tiszta oxigéngázt készíteni, és ezzel számos égési kísérletet is végzett.
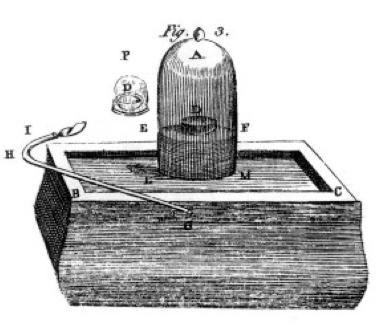
Lavoisier a mérés megszállottja volt., Kidolgozott, mindenre kiterjedő mérőberendezést fejlesztett ki. Foszfort éget, amint az az 1. ábrán látható, és megfigyeli egy fehér pelyhes termék kialakulását. A foszfor (ebben az esetben a reagens) nem volt vízben oldható, de a termék volt, ezért nagyon óvatosan gyűjtötte össze a terméket, vízzel mosva elválasztva a nem reagáló foszfortól. Szárítás után meg tudta mérni, hogy mennyi foszfor égett, mennyi oxigént fogyasztott (mert ismerte az oxigéngáz sűrűségét), és mennyi termék alakult ki., Megállapította, hogy a termék tömege az elfogyasztott reagens tömegének összege, minden kísérletben. Ez a tömegmegőrzés törvénye (amelyet valójában néhány korábbi alkimista és vegyész is használt). Azt is megfigyelte, hogy a foszfornak nincs íze, de a termék, amelyet foszforsavnak nevezett, savanyú. Ezekből a kísérletekből tudta, hogy sok esetben az elemek csak bizonyos arányban kombinálódnak, valamint hogy az oxigén két különböző arányban kombinálható a kénnel, a foszforral stb., Megadta nekünk a ma is használt terminológiát: a kénsav kénből és több oxigénből áll, a kénsav kénből és kevesebb oxigénből áll. – az ous kevesebb oxigént jelent; – az ic több oxigént jelent. A részleteket lásd a nómenklatúra oldalon.
Lavoisier nagy figyelmet fordított a pontosságra és a pontosságra. Például az imént leírt kísérletben megmérte a gáz térfogatát a csengőedényben a reakció előtt és után, de megjegyezte, hogy a reakció után meg kell várnia, amíg a hőmérséklet visszatér ahhoz, ami volt, amikor eredetileg mért., Ha a gáz forró, amikor a reakció után méri a térfogatát, akkor kibővül, a szokásos sűrűség pedig nem érvényes. Ez szisztematikus hibát vezetne be a mérésekbe: minden alkalommal, amikor végrehajtja a kísérletet, azt fogja gondolni, hogy több gáz maradt, mint valójában, és a mérés nem lesz pontos. Ha a kísérlet átlagos eredménye közel van a megfelelő értékhez, akkor pontos. Azonban, ha a kísérlet ad nagyon különböző számokat minden alkalommal, akkor is, ha az átlag helyes, a kísérlet pontos, ez nem pontos., A pontosság a különbség a “2 óra körül” találkozó és a “találkozó” között 3 perc 27 másodperccel 2 óra előtt.”A pontosság az, hogy mennyire specifikus vagy, mennyi részletet használ. Lavoisier is segített fejleszteni a rendszer egységek (kg, L, m), amelyek jelenleg használatban Koreában és sok más országban.

összességében, bár nem tett nagyon sok eredeti kísérletet, amelyet senki más nem tett korábban, nagyon óvatosan végezte kísérleteit, így a lehető legpontosabbak és pontosak voltak, majd világosan gondolkodott róluk, és szavakat hozott létre a vegyi anyagok és ötletek leírására, amelyek segítettek mindent világosabbá tenni., Ha elolvassa a lavoiser előtt írt kémiai tankönyvet, akkor nagyon zavaros lesz, mert a vegyi anyagok nevei a történelemre épülnek (és úgy hangzik, mintha Harry Potterből származnának), ahelyett, hogy a vegyi anyagok alapján lennének. Ha elolvassa a lavoiser után írt kémiai szöveget, felismeri a nyelvet hasonlónak, mint amit ma használunk.
összefoglaló
A pontosság leírja, hogy a mért érték mennyire közel van a tényleges értékhez. A pontosság leírja, hogy a mért értékek egy csoportja mennyire ért egyet egymással., A tömegmegőrzési törvény kimondja, hogy az anyagot nem lehet kémiai vagy fizikai eljárással létrehozni vagy megsemmisíteni. Ez azt eredményezi, hogy minden kísérletben felhasznált reagens tömegének összege megegyezik a termék tömegével. A kémiai változások magukban foglalják az anyag kémiai azonosságának megváltoztatását, hogy új anyagok alakuljanak ki. A fizikai változások magukban foglalják az anyag megváltoztatását kémiai identitásának megváltoztatása nélkül. Az égés és a rozsdásodás két példa a kémiai folyamatokra, míg a forralás és az olvadás a fizikai folyamatok példái., Kémiai reakciók magában fordult fehérjék, vegyi anyagok, hogy fogyasztott a folyamat kémiai változás, a termékek, vegyi anyagok termelt a folyamat kémiai változás, hogy az összetétele más, a fehérjék. A korlátozó reagens meghatározza vagy korlátozza a kémiai reakcióból előállítható termék mennyiségét.
külső Link
- CrashCourse Chemistry: the Fundamental Law (11 min)
-
Emily V Eames (City College of San Francisco)