The chemical element hafnium is classed as a transition metal . It was discovered in 1923 by Georg von Hevesy and Dirk Coster.

Data Zone
| Classification: | Hafnium is a transition metal |
| Color: | silvery |
| Atomic weight: | 178.,49 |
| State: | solid |
| Melting point: | 2230 oC, 2503 K |
| Boiling point: | 4600 oC, 4873 K |
| Electrons: | 72 |
| Protons: | 72 |
| Neutrons in most abundant isotope: | 108 |
| Electron shells: | 2,8,18,32,10,2 |
| Electron configuration: | 4f14 5d2 6s2 |
| Density @ 20oC: | 13.,2 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 13.6 cm3/mol |
| Structure: | hcp: hexagonal close pkd |
| Hardness: | 5.5 mohs |
| Specific heat capacity | 0.14 J g-1 K-1 |
| Heat of fusion | 27.2 kJ mol-1 |
| Heat of atomization | 621 kJ mol-1 |
| Heat of vaporization | 575.,0 kJ mol-1 |
| 1st ionization energy | 658.5 kJ mol-1 |
| 2nd ionization energy | 1440 kJ mol-1 |
| 3rd ionization energy | 2250 kJ mol-1 |
| Electron affinity | 178 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 1.,3 |
| Polarizability volume | 16.,none |
| Oxide(s) | HfO2 |
| Hydride(s) | HfH2 |
| Chloride(s) | HfCl4 |
| Atomic radius | 155 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 23.,2 W M-1 K-1 |
| elektromos vezetőképesség | 3,4 x 106 S M-1 |
| fagyasztási/Olvadáspont: | 2230 oC, 2503 K |

hafnium fém ezüst színű. Általában meglehetősen szürkenek tűnik a levegőben kialakuló oxidréteg miatt. A hafnium por, az oxidréteg nélkül, spontán gyulladhat a levegőben. Kép Ref., (1)
hafnium felfedezése
hafnium létezését eredetileg Dmitrij Mendelejev orosz kémikus jósolta meg. Az 1869-es “a kémiai elemek periodikus törvénye” című könyvében megjósolta, hogy létezik olyan elem, amely hasonló tulajdonságokkal rendelkezik, de nehezebb, mint a titán és a cirkónium.
1911-ben Georges Urbain, a ritkaföldfémek felfedezője úgy gondolta, hogy felfedezte a 72-es elemet a ritka földek spektrális elemzése során. Ezt az új elemet celtiumnak nevezte, de három évvel később kimutatták, hogy a már felfedezett lantanidok keveréke., (2)
1921-ben Neils Bohr javasolta Georg von Hevesy Magyar kémikusnak, hogy keresse meg a cirkónium ércek hiányzó elemét. (3) Bohr atomszerkezet kvantumelmélete szerint ezek a fémek hasonló kémiai tulajdonságokkal rendelkeznek, így jó esély volt arra, hogy ugyanabban az ércben találhatók.
Bohr tanácsát követve, Hevesy és Dirk Coster holland fizikus 1923-ban röntgen-spektroszkópiával fedezte fel a hafniumot a cirkónium ércek elemzésére.
Anton Eduard van Arkel és Jan Hendrik de Boer 1925-ben fedezték fel a nagy tisztaságú hafnium előállításának módszerét., A Hafnium tetraiodid (HfI4) egy fehér, forró volfrámszálon bomlik, amely tiszta hafnium kristályrudat hoz létre. Ez az úgynevezett crystal bar folyamat.
az elemet hafniumnak hívták a Latin “Hafnia” név után, azaz Koppenhága, a város, ahol az elemet felfedezték.

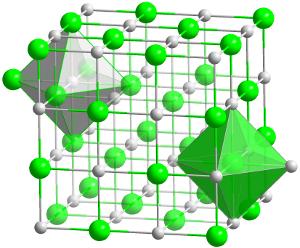
hafnium-karbid (hfc) kristályszerkezete., Ez a legtöbb tűzálló (hőálló) vegyület ismert bármely két elem 1: 1 arányban.

a hafniumot atomreaktor vezérlőrudaiban használják nukleáris tengeralattjárókban

fehér hafnium (IV) – oxid (hfo2). A hafnium-oxid alapú vegyületeket Szilícium chipekbe vezetik be, hogy kisebb, nagy teljesítményű processzorokat állítsanak elő, jobb energiahatékonysággal.,
megjelenés és jellemzők
káros hatások:
a hafnium nem mérgező. Porított formában piroforos (spontán gyulladhat).
jellemzők:
a Hafnium fényes, ezüstös, gömbgrafitos fém.
kémiailag hasonló a cirkóniumhoz.
ha vegyületekben jelen van, a hafnium elsősorban IV.
a hafnium oxidfólia képződése miatt ellenáll a korróziónak a kitett felületeken.
Ez nem befolyásolja az összes sav (kivéve a hidrogén-fluorid) és az összes lúgok.,
a hafnium a halogénekkel tetrahalidokat képez, magas hőmérsékleten pedig szénnel, bórral, nitrogénnel, oxigénnel, szilíciummal és kénnel reagál.
a hafnium
a hafniumot atomreaktor-vezérlőrudakhoz használják, mivel képes a neutronok elnyelésére és jó mechanikai és korrózióállósági tulajdonságaira. Ez teljes ellentétben áll a cirkóniummal, amely bár kémiailag nagyon hasonlít a hafniumhoz, nagyon gyenge a neutronok elnyelésében., Ezért cirkóniumot használnak az üzemanyagrudak burkolatában (külső rétegében), amelyen keresztül fontos, hogy a neutronok könnyen utazhassanak.
a hafniumot fotografikus izzókban, izzólámpákban, valamint elektronikus berendezésekben katódként és kondenzátorként is használják.
hafnium ötvözetek több más fémmel, például vassal, nióbiummal, tantállal és titánnal.
a Hafnium-nióbium ötvözetek például hőállóak, és űrkutatási alkalmazásokban, például űrrakéta-motorokban használják őket.,
a hafnium-karbidot tűzálló tulajdonságai miatt magas hőmérsékletű kemencék / kemencék vezetésére használják(magas hőmérsékleten nem olvad).
a hafnium alapú vegyületeket a számítógépek integrált áramköreinek 45 nm-es generációjában használják kapuszigetelőkben.
a hafnium-oxid alapú vegyületeket szilícium alapú chipekbe vezetik be, hogy kisebb, energiatakarékosabb és teljesítményre csomagolt processzorokat állítsanak elő(4).
Abundance and Isotopes
Abundance earth ‘ s crust: 3,3 parts per million by weight, 0.,4 rész per millió moles
bőség naprendszer: 1 rész per milliárd tömeg, 0.01 rész per milliárd moles
költség, tiszta: $120 per 100g
költség, ömlesztett: $ per 100g
Forrás: hafnium nem található szabad a természetben, de megtalálható a legtöbb cirkónium ásványok koncentrációja között egy-öt százalék. Kereskedelmi forgalomban a hafniumot cirkónium-finomítás melléktermékeként állítják elő. Ezt a Kroll eljárással végezzük, csökkentve a tetrakloridot magnéziummal vagy nátriummal.,

- fotó: Deglr6328
- per Enghag, az elemek enciklopédiája: MŰSZAKI ADATOK – történelem – feldolgozás – Alkalmazások, 2008, John Wiley& sons, p527.
- Bob Weintraub, George de Hevesy (1885 1966) (pdf dokumentum).
- Aile Tamm, a Ciklopentadienil-alapú prekurzorokból származó nagy Permittivitású szigetelők atomi réteges lerakódása, 2010, Tartu University Press, p18.,
Idézni ezt az Oldalt
Az online összekapcsolása, kérem másolja be az alábbi:
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium</a>
vagy
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium Element Facts</a>
cite ez az oldal egy tudományos dokumentum, kérjük, használja a következő KÉPVISELŐ-kompatibilis idézet:
"Hafnium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hafnium.html>.