Termodynamika je obor physicswhich zabývá energie a práce systému.Termodynamika se zabývá pouze rozsáhlou reakcí systému, kterou můžeme pozorovat a měřit v experimentech. Malé plynové interakce jsoupopsané kinetickou teorií plynů.Existují tři principypásy termodynamiky, které jsou popsány na samostatných skluzavkách., Každý zákon vede k definicitermodynamické vlastnostikteré nám pomáhají porozumět a předvídat fungování fyzickésystému. Představíme několik jednoduchých příkladů těchto zákonů avlastnosti pro různé fyzikální systémy, i kdyžvelmi se zajímáme o termodynamiku propulzních systémůvysoké rychlostní toky.Naštěstí mnoho z nichklasické příklady termodynamiky zahrnují dynamiku plynu.,
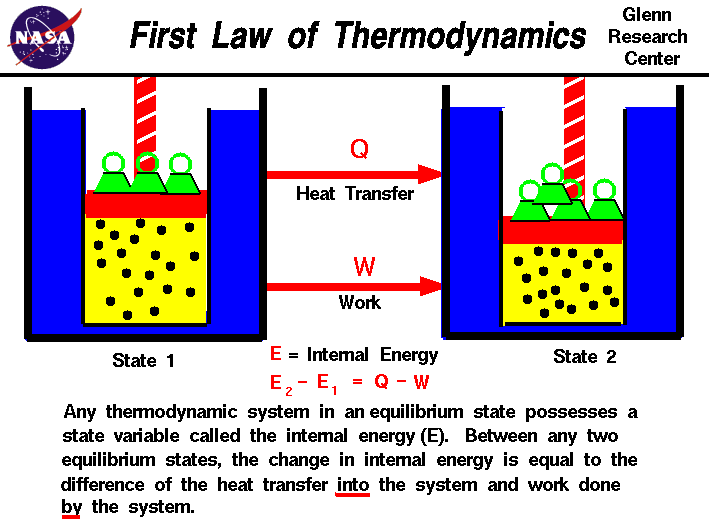
V naší postřehy z práce,nebo plynu, zjistili jsme, že množství práce závisí nejen na počátečním a konečným státy gasbut také na proces, nebo cestu, která produkuje konečný stav.Podobně množství tepla převedeného do, neboz plynu také závisí na počátečním a konečném stavu aprocesu, který vytváří konečný stav., Mnoho pozorování realgases ukázaly, že rozdíl tepelného toku do gasand práci plynu závisí pouze na počáteční a finalstates plynu a nezávisí na proces nebo pathwhich produkuje konečný stav. To naznačuje existenci pro proměnné, se nazývá vnitřní energie plynu,které závisí pouze na stavu plynu a ne na proces.Vnitřní energie je stavová proměnná, stejně jako teplota nebotlak., První zákon termodynamiky definuje interníenergie (E) se rovná rozdílu přenosu tepla (Q) do systému a práce (W) provedené systémem.
E2-E1 = Q – W
v definici jsme zdůraznili slova“ do „A“ by“. Teplo odstraněné ze systémubylo přiřazeno záporné znaménko v rovnici. Podobně workdone v systému je přiřazeno záporné znaménko.,
vnitřní energie je forma energie, jako potenciální energie objektu v určité výšce nad zemí, nebo kineticenergy objektu v pohybu. Stejně jako potenciální energiemohou být přeměněny na kinetickou energii při zachování celkové energiesystému může být vnitřní energie termodynamického systému přeměněna buď na kinetickou nebo potenciální energii. Stejně jako potenciálníenergie, vnitřní energie může být uložena v systému.Všimněte si však, že teplo apráce nelze skladovat nebo konzervovat nezávisle, protože závisína procesu., První zákon termodynamiky umožňuje mnohomožné stavy systému existují,ale v přírodě existují pouze určité stavynalezeno. Tyto dva zákony termodynamiky pomáhajívysvětlit toto pozorování.
v Případě, že systém je zcela izolován od vnějšího prostředí, lze mít změnu stavu, ve kterém žádné teplo se přenáší do systému. Vědci odkazují na proces, který nezahrnuje teplotransfer jako adiabatický proces.,Implementace prvního zákona termodynamiky pro plyny představuje dalšíužitečná stavová proměnná nazývaná entalpykterý je popsán na samostatné stránce.
Aktivity:
Prohlídky
-
 Termodynamiky:
Termodynamiky: 
Navigace ..
![]()
![]()
Úvodní stránka Průvodce pro začátečníky