Abilitati de a Dezvolta
- Înțeleg de ce Lavoisier este uneori numit „Părintele Chimiei Moderne”
- Distinge precizie de precizie
Deci ce s-a întâmplat la rândul său, alchimie, care a fost ca poțiune magică-fabricarea berii în Harry Potter, în știința de chimie? A fost măsurarea. Măsurarea atentă și atentă a cantităților, cum ar fi masele, volumele, densitățile, temperaturile, presiunile.
un erou timpuriu de măsurare a fost Antoine Lavoisier., A fost unul dintre primii oameni de știință chimici adevărați. El a efectuat experimente atente și a încercat să nu tragă concluzii, cu excepția celor cerute de datele sale. El a spus că faptul, ideea și cuvântul ar trebui să fie cât mai strâns legate: că nu vă puteți îmbunătăți limba fără a vă îmbunătăți gândirea și că nu vă puteți îmbunătăți gândirea fără a vă îmbunătăți limba. Așa că a fost pionierul unei nomenclaturi chimice sistematice care este în esență ceea ce folosim astăzi., În mod remarcabil, dacă citiți textul său, scris în 1789, destinat să introducă chimia pentru începători, o mare parte din ea este încă perfect de înțeles și chiar corectă prin standardele moderne.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier prima descrie stări ale materiei: gaze, lichide și solide. El subliniază atunci când un material solid este încălzit, acesta tinde să se extindă, devenind mai întâi un lichid, care ocupă un volum constant, dar poate fi turnat, spre deosebire de un solid., Mai multă încălzire și devine un gaz, pe care îl descrie drept elastic, deoarece se va extinde sau se va comprima la diferite volume în funcție de presiune. Spre deosebire de filozofii greci, el a înțeles că aceasta este o schimbare fizică, nu și o modificare chimică, și el are o bună submicroscopic scară intuiția a ceea ce se întâmplă: particulele de material nu se schimba, doar se mai mult în afară.,
a ars sulf, fosfor și cărbune (carbon) și a făcut observații atente, adesea folosind borcanul clopot peste o găleată de mercur așa cum se arată în desenul din cartea sa, Figura 1. Acesta este un exemplu de schimbare chimică sau reacție chimică, în care substanțele chimice reactante se transformă în diferite substanțe chimice ale produsului. Dacă aprindeți sulful din vasul etichetat D sub borcanul de aer, acesta arde până când se stinge lăsând ceva sulf suplimentar. Aerul rămas în borcan nu mai este bun pentru respirație. Dacă puneți un șoarece în borcan, acesta va muri, la fel cum a făcut flacăra., Acest lucru demonstrează conceptul de limitare a reactantului. Reacția sau arderea sa oprit atunci când a rămas fără oxigen, lăsând în primul rând azot (și câteva urme de alte gaze) în borcan. Priestley, un alt om de știință, i-a arătat cum să pregătească gazul pur de oxigen și a folosit acest lucru pentru a face și multe experimente de ardere.
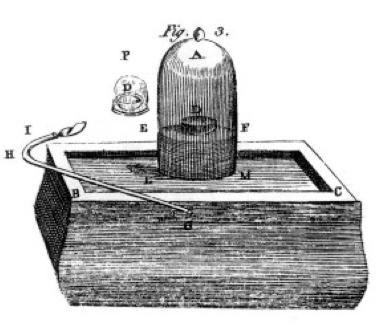
Lavoisier a fost obsedat de măsurare., El a dezvoltat aparate elaborate pentru măsurarea totul. El ar arde fosfor, așa cum se arată în Figura 1, și să observe formarea unui produs alb sub formă de fulgi. Fosforul (reactantul în acest caz) nu era solubil în apă, dar produsul era, așa că a colectat produsul foarte atent, separându-l de fosforul nereacționat prin spălare cu apă. După uscare, a putut măsura cât de mult a ars fosforul, cât de mult oxigen a fost consumat (pentru că știa densitatea gazului de oxigen) și cât de mult s-a format produsul., El a descoperit că masa produsului a fost suma maselor de reactant consumate, în fiecare experiment. Aceasta este legea conservării masei (pe care, de fapt, o folosiseră și unii alchimiști și chimiști anteriori). El a observat, de asemenea, că fosforul nu are gust, dar produsul, pe care la numit acid fosforic, este acru. El știa din aceste experimente că, în multe cazuri, elementele se combină numai în anumite proporții și, de asemenea, că oxigenul se poate combina cu sulf, fosfor etc. în două rapoarte diferite., El ne-a dat terminologia pe care o folosim și astăzi: acidul sulfuric este compus din sulf și mai mult oxigen, acidul sulfuros este compus din sulf și mai puțin oxigen. -ous înseamnă mai puțin oxigen; – ic înseamnă mai mult oxigen. Consultați pagina nomenclatură pentru detalii.
Lavoisier a acordat o atenție deosebită preciziei și preciziei. De exemplu, în experimentul pe care tocmai l-am descris, el a măsurat volumul de gaz din borcanul clopotului, înainte și după reacție, dar a observat că după reacție, trebuie să așteptați până când temperatura revine la ceea ce a fost când ați măsurat inițial., Dacă gazul este fierbinte atunci când măsurați volumul său după reacție, acesta se va extinde și densitatea standard nu se va aplica. Acest lucru ar introduce o eroare sistematică în măsurători: de fiecare dată când efectuați experimentul, veți crede că există mai multe resturi de gaz decât există în realitate și măsurarea dvs. nu va fi exactă. Dacă rezultatul mediu al experimentului dvs. este aproape de valoarea corectă, este corect. Cu toate acestea, dacă experimentul dvs. oferă numere foarte diferite de fiecare dată, chiar dacă Media este corectă și experimentul este corect, nu este precis., Precizia este diferența dintre întâlnirea „în jurul orei 2” și întâlnirea „la 3 minute și 27 de secunde înainte de ora 2 pm.”Precizia este cât de specific ești, cât de multe detalii folosești. Lavoisier a contribuit, de asemenea, la dezvoltarea sistemului de unități (kg, L, m) care sunt utilizate în prezent în Coreea și în multe alte țări.

în General, în timp ce el nu a facut foarte multe experimente pe care nimeni altcineva nu a făcut-o înainte, a făcut experimente cu foarte mare atenție, astfel încât acestea au fost la fel de exacte și precise posibil, și apoi el a crezut despre ei în mod clar și a creat cuvinte pentru a descrie produse chimice și idei care au ajutat face totul mai clar., Dacă citiți un manual de chimie scris înainte de Lavoiser, veți fi foarte confuz, deoarece numele substanțelor chimice s-ar baza pe istorie (și ar suna ca și cum ar veni de la Harry Potter), în loc să se bazeze pe ceea ce sunt substanțele chimice. Dacă citiți un text de chimie scris după Lavoiser, veți recunoaște limba ca fiind similară cu ceea ce folosim astăzi.
rezumat
precizia descrie cât de aproape este o valoare măsurată de valoarea reală. Precizia descrie cât de bine un grup de valori măsurate sunt de acord între ele., Legea conservării masei afirmă că materia nu poate fi nici creată, nici distrusă printr-un proces chimic sau fizic. Aceasta are ca rezultat suma maselor de reactant consumate în orice experiment este egală cu masa produsului. Modificările chimice implică schimbarea identității chimice a unei substanțe, astfel încât se formează substanțe noi. Schimbările fizice implică modificarea unei substanțe fără a-și schimba identitatea chimică. Arderea și ruginirea sunt două exemple de procese chimice, în timp ce fierberea și topirea sunt exemple de procese fizice., Reacțiile chimice implică transformarea reactanților, substanțe chimice care se consumă în procesul de schimbare chimică, în produse, substanțe chimice produse prin procesul de schimbare chimică care au o compoziție diferită de reactanți. Un reactant limitator determină sau limitează cantitatea de produs care poate fi produsă dintr-o reacție chimică.
în Afara Linkul
- CrashCourse Chimie: Legea Fundamentală (11 min)
Contribuabili și Atribuții
-
Emily V Elena (Colegiul din San Francisco)