
Discuții
Pentru produse chimice să reacționeze, obligațiunile lor trebuie să fie rearanjate, pentru că legăturile în care produsele sunt diferite de cele din reactanți.,Cel mai lent pas în rearanjarea legăturii produce ceea ce se numește o stare de tranziție – o specie chimică care nu este nici un reactant, nici un produs, ci este un intermediar între cele două.
energia este necesară pentru a forma starea de tranziție. Această energie se numește energie de activare sau Ea.Citirea diagramei de mai jos de la stânga la dreapta arată progresul unei reacții pe măsură ce reactanții trec prin starea de tranziție pentru a deveni produse.,
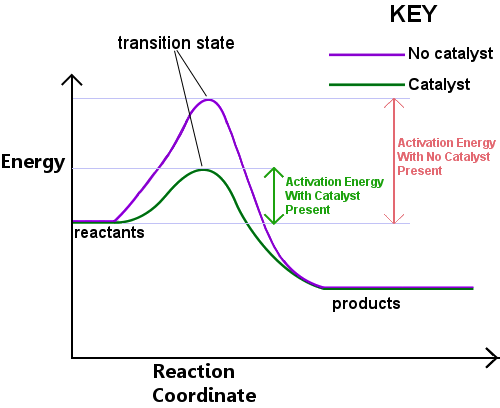
energia de activare poate fi considerată ca o barieră în calea unei reacții chimice, un obstacol care trebuie depășit.Dacă bariera este ridicată, puține molecule au suficientă energie cinetică pentru a se ciocni, a forma o stare de tranziție și a traversa bariera.Reactanții cu energie mai mică decât Ea nu pot trece prin starea de tranziție pentru a reacționa și a deveni produse.un catalizator funcționează prin furnizarea unui traseu diferit, cu ea mai mică, pentru reacție. Catalizatorii reduc bariera energetică.,Diferite traseul permite bond rearanjamente necesare pentru conversia reactanților la produsele să aibă loc mai rapid, cu un consum de energie mai mic.În orice interval de timp dat, în prezența unui catalizator permite un procent mai mare de reactant specii pentru a ridica suficientă energie pentru a trece prin starea de tranziție și să devină produse.Exemplul 1: procesul Haber procesul Haber, care este folosit pentru a produce amoniacul din hidrogen și azot, este catalizat de fier, care furnizează situri atomice pe care legăturile reactantului se pot rearanja mai ușor pentru a forma starea de tranziție.,
Exemplu 2: Enzime
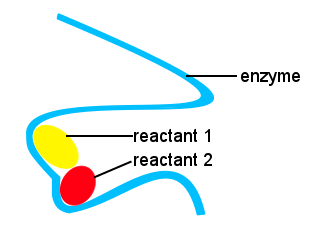
În corpurile noastre, și în alte lucruri vii, enzimele sunt utilizate pentru a accelera reacțiile biochimice. O enzimă este un tip de catalizator.Viața complexă ar fi imposibilă fără enzime care să permită reacțiile să aibă loc la viteze adecvate.Formele enzimelor împreună cu locațiile enzimei care se leagă de reactanți oferă o cale alternativă de reacție, permițând moleculelor specifice să se unească pentru a forma o stare de tranziție cu o barieră energetică redusă de activare.,în schema de mai jos, enzima cu lanț lung furnizează situsuri pentru ca moleculele reactante să se unească pentru a forma o stare de tranziție cu o energie de activare scăzută.
catalizatorii nu pot schimba poziția unui echilibru chimic – reacțiile înainte și înapoi sunt ambele accelerate, astfel încât constanta de echilibru Keq să fie neschimbată.Cu toate acestea, prin eliminarea produselor din amestecul de reacție pe măsură ce se formează, rata globală de formare a produsului poate fi în practică mărită.