Ferdigheter til å Utvikle
- Forstå hvorfor Lavoisier er noen ganger kalt «Far til Moderne Kjemi»
- Skille korrektheten fra presisjon
Så hva som skjedde for å slå alkymi, som var som magisk trylledrikk-brygging i Harry Potter, i naturfag kjemi? Det var måling. Forsiktig, forsiktig måling av mengder, for eksempel masser, volumer, tetthet, temperatur, trykk.
En tidlig helten av målingen var Antoine Lavoisier., Han var en av de første virkelige kjemiske forskere. Han gjennomførte forsiktig eksperimenter, og prøvde å trekke noen konklusjoner, bortsett fra de som kreves av sine data. Han sa faktum, idé, og ordet skal være så tett som mulig: at du ikke kan forbedre ditt språk uten å forbedre din tenkning, og du kan ikke forbedre din tenkning uten å forbedre språket ditt. Så han utviklet en systematisk kjemisk nomenklatur som er i hovedsak hva vi bruker i dag., Bemerkelsesverdig, hvis du leser sin tekst, skrevet i 1789, hadde til hensikt å introdusere kjemi til nybegynnere, mye av det er fortsatt helt forståelig og selv riktig av moderne standarder.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier første beskriver stater av saken: gasser, væsker og faste stoffer. Han peker på når en solid materialet varmes opp, det har en tendens til å utvide seg, blir først en væske, som tar opp et konstant volum, men kan helles, i motsetning til en solid., Mer oppvarming, og det blir en gass, som han beskriver som elastisk fordi det vil utvide eller komprimere til ulike volumer avhengig av trykket. I motsetning til de greske filosofer, han forsto at dette er en fysisk forandring, ikke en kjemisk endring, og han har en god submicroscopic-skala intuisjon på hva som skjer: partikler av materialet forandrer seg ikke, de bare komme lenger fra hverandre.,
Han brente svovel og fosfor og trekull (karbon) og laget forsiktig observasjoner, ofte ved hjelp av bell jar over en bøtte med kvikksølv som er vist på tegningen fra hans bok, Figur 1. Dette er et eksempel på en kjemisk endring eller kjemisk reaksjon, som reaktant kjemikalier slå inn i ulike produkt kjemikalier. Hvis du lys svovel i fatet med bokstaven D på seg under bell jar av luft, det brenner helt til det går ut forlate noen ekstra svovel. Luften igjen i glasset er ikke lenger godt for å puste. Hvis du putter en mus i glasset, vil det dø, akkurat som flammen gjorde., Dette viser begrepet begrensende reaktant. Reaksjonen eller brennende stoppet da det kjørte ut av oksygen, og etterlot seg først og fremst nitrogen (og et par spore andre gasser) i glasset. Priestley, en forsker, viste ham hvordan å forberede ren oksygen gass, og han brukte dette til å gjøre mange brennende eksperimenter som godt.
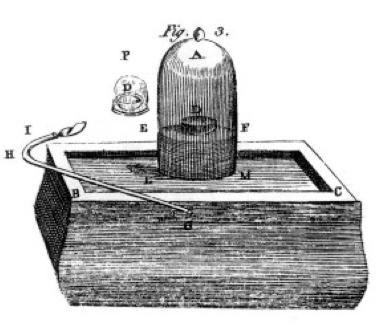
Lavoisier var besatt med måling., Han utviklet omfattende apparat for måling av alt. Han ville brenne fosfor, som vist i Figur 1, og se på dannelsen av en hvit flassende produktet. Fosfor (den reaktant i dette tilfellet) var ikke vannløselig, men produktet var, så han samlet produktet veldig nøye, som skiller den fra ureagert fosfor ved å vaske med vann. Etter tørking, kunne han måle hvor mye fosfor hadde brent, hvor mye oksygen hadde blitt konsumert (fordi han visste at tettheten av oksygen gass), og hvor mye produktet hadde dannet., Han fant ut at masse av produktet var summen av massene av reaktant konsumert, i hvert eksperiment. Dette er loven for bevaring av masse (som, faktisk, noen tidligere alkymistene og kjemikere hadde også brukes). Han har også observert at fosfor har ingen smak, men produktet, som han kalte phosphoric acid, er surt. Han visste fra disse eksperimentene som i mange tilfeller kombinere elementer i bestemte proporsjoner, og også for at oksygen kan kombinere med svovel, fosfor, etc i to ulike forhold., Han ga oss den terminologi vi er fortsatt i bruk i dag: svovelsyre er sammensatt av svovel og mer oksygen, sulfurous syre er sammensatt av svovel og mindre oksygen. -ous betyr mindre oksygen; -ic betyr mer oksygen. Se nomenklatur side for detaljer.
Lavoisier betalt hensyn til nøyaktighet og presisjon. For eksempel, i eksperimentet vi nettopp har beskrevet, han målte volumet av gass i bell jar, før og etter reaksjonen, men bemerket at det etter reaksjon, må du vente til temperaturen går tilbake til det den var da du målte opprinnelig., Hvis gassen er varm når du måle volumet etter reaksjon, vil det ha utvidet, og din standard tetthet vil ikke gjelde. Dette ville innføre en systematisk feil i målinger: hver gang du utfører eksperimentet, vil du tenke at det er mer gass til overs enn det faktisk er, og målingen blir ikke nøyaktig. Hvis den gjennomsnittlige resultatet av eksperimentet er i nærheten riktig verdi, det er korrekt. Imidlertid, hvis eksperimentet gir svært forskjellige tall hver gang, selv om det gjennomsnittlig er riktig, og eksperimentet er korrekt, det er ikke nøyaktig., Presisjon er forskjellen mellom å møte «rundt 2 o ‘clock» og møte «på 3 minutter og 27 sekunder før 2 pm.»Presisjon er hvordan bestemte du er, hvor mye detaljer du kan bruke. Lavoisier også bidro til å utvikle system for enheter (kg, L, m) som er i bruk i Korea og mange andre land.

Generelle, mens han gjorde ikke veldig mange originale eksperimenter som ingen andre hadde gjort før, gjorde han sine eksperimenter veldig nøye, så de var så nøyaktige og presise som mulig, og så tenkte han på dem tydelig, og opprettet ord for å beskrive kjemikalier og ideer som bidro til å gjøre alt klarere., Hvis du vil lese en kjemi lærebok skrevet før Lavoiser, vil du bli svært forvirret fordi navnene for kjemikalier vil være basert på historien (og ville høres ut som de kom fra Harry Potter), heller enn å være basert på hva kjemikalier. Hvis du vil lese en kjemi tekst skrevet etter Lavoiser, vil du kjenne språket som ligner på det vi bruker i dag.
Oppsummering
Korrektheten beskriver hvor nær en målt verdi er den faktiske verdien. Presisjon beskriver hvor godt en gruppe av målte verdier er enige med hverandre., Loven om konservering av masse sier at saken kan verken skapes eller ødelegges ved en kjemisk eller fysisk prosess. Dette resulterer i summen av massene av reaktant forbrukes i noen eksperiment er lik massen av produktet. Kjemiske endringer innebære endring et stoff som er kjemisk identitet slik at nye stoffer blir dannet. Fysiske endringer innebære å endre et stoff uten å endre den kjemiske identiteten. Forbrenning og rustdannelse er to eksempler på kjemiske prosesser, mens koking og smelting er eksempler på fysiske prosesser., Kjemiske reaksjoner innebære å slå reaktantene, kjemikalier som blir konsumert i prosessen med å kjemisk endre, til produkter, kjemikalier som produseres gjennom prosessen med kjemisk endring som har en annen sammensetning fra reaktantene. En begrensende reaktant bestemmer, eller grenser, for den mengden av produkter som kan produseres fra en kjemisk reaksjon.
Utenfor Link
- CrashCourse Kjemi: Den Fundamentale Loven (11 min)
Bidragsytere og Attribusjoner
-
Emily V Eames (City College of San Francisco)