En katalysator er et stoff som hastigheter opp til en kjemisk reaksjon, men er ikke forbrukes av reaksjon, derav en katalysator som kan utvinnes kjemisk uendret ved utgangen av reaksjonen det har vært brukt til å øke hastigheten, eller katalysere.

Diskusjon
For kjemikalier til å reagere, deres obligasjoner må omorganiseres, fordi obligasjoner i produkter som er forskjellige fra de i reaktantene.,Den mest langsomme skritt i bond omorganisering produserer det som er betegnet som en overgang stat – en kjemisk arter som er verken en reaktant eller et produkt, men er en mellomting mellom de to.
Energi er nødvendig for å danne overgangen staten. Denne energien kalles inhibitorer, eller Ea.Å lese diagrammet nedenfor fra venstre til høyre viser fremdriften til en reaksjon som utgangsstoff passere gjennom overgangen staten til å bli produkter.,
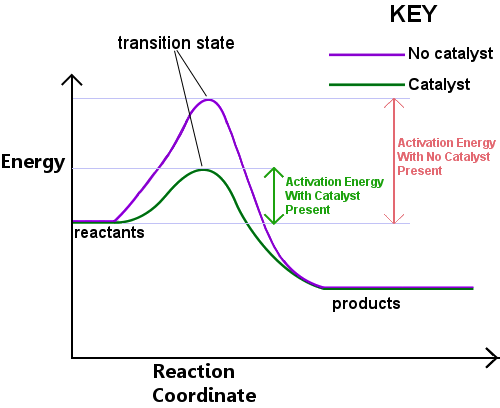
aktivering energi kan bli tenkt på som en barriere for en kjemisk reaksjon, et hinder som må krysses.Hvis barrieren er høy, få molekyler har nok kinetisk energi til å kollidere, danner en overgang state, og krysse barrieren.Reaktantene med energi lavere enn Ea ikke kan passere gjennom overgangen staten til å reagere og bli produkter.
En katalysator fungerer ved å gi en annen rute, med lavere Ea, for reaksjonen. Katalysatorer lavere energi-barriere.,Den annen rute lar bond rearrangements trengte å konvertere reaktanter til produkter til å ta plass lettere, med et lavere energi-inngang.I et gitt tidsintervall, nærvær av en katalysator gjør at en større andel av reaktant arter å plukke opp nok energi til å passere gjennom overgangen stat og bli produkter.
Eksempel 1: Haber Prosess
Haber-prosessen, som er brukt til å lage ammoniakk fra hydrogen og nitrogen, er catalyzed av jern, som gir atomic nettsteder som reaktant obligasjoner kan omorganisere lettere å danne overgangen staten.,
Eksempel 2: Enzymer
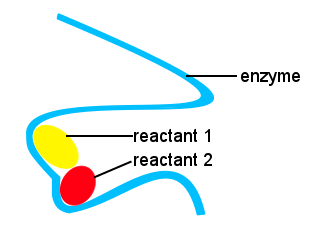
I kroppene våre, og i andre levende ting, enzymer brukes til å øke hastigheten biokjemiske reaksjoner. Et enzym er en type katalysator.Komplekse liv ville være umulig uten enzymer for å tillate reaksjoner til å skje på egnet hastigheter.Figurene av enzymer sammen med plasseringer på enzymet som binder seg til reaktantene gi en alternativ reaksjon veien, slik at spesifikke molekyler til å komme sammen for å danne en overgang stat med en redusert aktivering energi-barriere.,
I den skjematiske nedenfor, lang kjede enzym gir nettsteder for reaktant molekyler til å komme sammen for å danne en overgang stat med en lav aktivering energi.
Katalysatorer kan ikke forskyve plasseringen av en kjemisk likevekt – fremover og bakover reaksjoner er både akselereres slik at likevekt konstant Keq er uendret.Imidlertid, ved å fjerne produkter fra reaksjonsblandingen som de danner, den generelle satsen på produktet dannelse kan i praksis være økt.