GERDおよびAFは、さまざまな臨床実practicesにおいて経路を横断する二つの病気であることが明らかになっており、さらなる調査が必要である。, 胃腸症状と不整脈との間の重複とリンクは、Ludwig Roemheldによって最初に観察され、食道胃酸がarrhyth脈関連症状を誘発することができた胃-cardiaとしても知られる”Roemheld Gastrocardiac Syndrome”とラベル付けされた。, リンクを見つけ、正確に胃cardiaを診断することは頻繁にこのシンドロームを、食道およびアトリウムの近い位置内の発火のような引き起こすことができるさまざまな考えられるメカニズムによって貢献されることがこうかつである自己免疫の無秩序、共通の神経の神経支配、活発な有酸素運動、冠状血の流れの機械流入、障害、および裂孔のヘルニア。,
いくつかの研究は、酸抑制療法として使用されるプロトンポンプ阻害剤(PPIs)は、おそらくAFの治療に使用される典型的な抗不整脈薬の実行可能な代 PPlsは、コストが低く、副作用が低いという利点があり、正常な洞調律を誘導するのに役立つことが分かっていますが、その完全な感情性はまだ決定されていません。,
メカニズムはまだ不明ですが、逆流症が発作性AF(PAF)を引き起こし、維持することができることを報告する限られた観察研究を通じて症例報告からいくつかの証拠があります。 酸の還流はPAFで起因するメカニズムの細道の必要な役割を担うかもしれない発火の原因となるゲルトを引き起こす食道の粘膜に苛立ちを引き起こすことができます。 食道の隣にある迷走神経の炎症は、心臓病がなくてもAFに影響を与えます。, また、PAFが若者と中年の健康なアスリート(自転車、ランナー、クロスカントリースキーヤーなど)の両方に現れる可能性があることを示す証拠が増えています。 この証拠はPAFがAFとGERD間のリンクのためにこれらの運動選手で現われるかどうか私達が疑問に思うことを可能にします。 この記事のこの部分では、上部消化管系と心臓血管系との間のいくつかの生理学的関係を詳細に説明しようとします。,
運動は、特に競争力のあるレベルで、AFと関連しています
様々な研究を通じて、健康な人の有酸素運動は、時間と運動の強さとともに増加する食道酸性逆流をもたらすことができることが実証されています。 食道酸クリアランスの減少,胃の運動性および吸収の減少,下部食道括約筋の弛緩,蠕動食道運動の減少または無秩序,および胃血流の減少を含むいくつかの逆流メカニズムが検討されている。, 運動誘発性胃食道逆流(GER)に関与する可能性のあるメカニズムは、下部胃食道接合部(特にフラップ弁)の構造的完全性である。 コリングスら。 精力的な練習によって行った30人の訓練された運動選手の調査の中では、多数に還流の高められた刺激があったか、または還流と関連付けられる徴候があったことを報告しました。 この研究では、運動選手が軽くて健康的な食事を食べ続けるにつれて、症状は和らぐことはなかったことがさらに示された。, 研究を続けて、食道酸度の程度は、無症候性であった10健康でフィットスプリンターで調査されました。 ハード強度ランニングに中等度の80分の後、選手は軽度の逆流性食道炎の兆候を示しました。 PHは断食ランナーの4.9%未満であり、ランナーの17.2%であった。 このような研究から、実際にはGERDとその症状と運動との間に相関があると結論づけることは論理的であるだけである。 下部食道炎症(食道炎)は、AFおよび他の心臓不整脈につながる可能性がある。, 二つの議論は、過度の運動のレジメンは、暗黙の仮説である酸逆流によって媒介されるAFに資する可能性があることを示唆している。 PPIsは運動誘発性GERの治療に使用できることが高く報告されています。
炎症プロセスとAFの発症に及ぼす影響
炎症のマーカーと心房細動マーカーとの相関については、C反応タンパク質(CRP)やIL-1βやIL-6などのインターロイキン(図1)との相関が注目され、研究されている。, 従ってGERDはまたいろいろ炎症性仲介物質を解放するかもしれ全身の発火を引き起こす。 炎症による循環CRPの増加に伴い、それは心房組織損傷につながる古典的な補体経路活性化を介してAFの出現またはAFの症状を促す可能性がある。 これはまた膜の機能障害で起因するナトリウムおよびカルシウム処理の変化をもたらすphosphocholineに結合するCRPによって引き起こされることができます。, 慢性炎症の徴候に対する別の指針は、CRPの増加であり、これはAFの発生、除細動の有効性、再出現および予後と相関する。
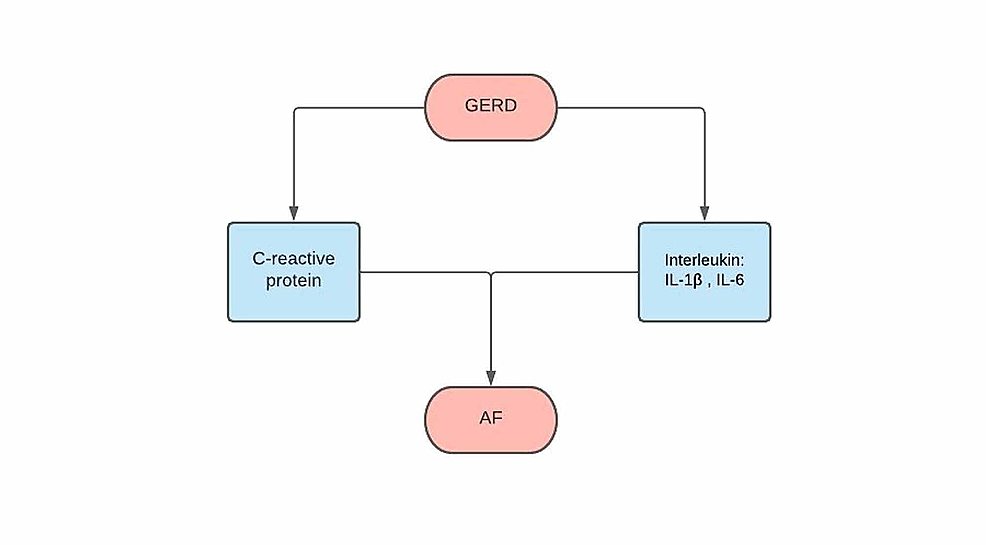
図1:炎症性マーカー
GERD:胃食道逆流症、AF:心房細動
さらに、酸逆流が炎症を引き起こす可能性があることが以前の研究を通じて指摘されている。食道粘膜。, 下部食道の炎症は、食道壁が貫通する可能性があり、迷走神経に影響を与える。 これは、食道粘膜が心房(特に左心房)に近接しているため、およびそれが局所受容体をどのように変化させることができるかによって起こり得る。 これは迷走神経の刺激による心臓リズムの求心性遠心性逆流機構を誘発し,心臓不整脈を促進する可能性がある。,
下部食道の炎症によって引き起こされるGERDの例を通して、炎症が食道壁を貫通し、心膜の薄層に交差し、心房心筋炎および局所心膜炎を引き起こ Frustaciらによって行われた研究を通じて。 中隔生検を行い,孤立心房細動を有する患者は心房リンパ単核浸潤を有することが分かった。,
自律神経の影響はAFを誘導する
特定の例では、心房不整脈のエピソードは、嚥下や食道を通って胃に入る食物などの喉の機械的影響によって引き起こされることがあることが分かっている。 発作性AFは、排便、腹部の膨満感、および摂食および嚥下を含むメカニズムを含む様々な胃腸機構によって刺激され得る。,
食道の神経に関連する心臓応答は、Tougasらによって行われた研究を通じて1990年代には早くも報告されている。 whoは、食道の機械的刺激と心拍数およびその変数の影響との相関を調査することができた。 これは周波数領域解析のパワースペクトルと呼ばれる解析を使用して行われました。, この分析を通じて、彼らは、機械的食道刺激によって引き起こされる基本心拍数に関連する高周波成分(HF)の増加および低周波成分(LF)の減少を見出
上記の研究では、自律神経経路が不均衡(sympath神経不均衡)である場合、GERDと関連しながらAFを引き起こすことが確認されている。 副交感神経経路とsympathetic神経経路の両方がAFにおいて中心的な役割を果たすが、副交感神経経路はより重要な役割を果たす。,
裂孔ヘルニアと機械的影響
患者が裂孔ヘルニア(HH)を有する場合、食物および酸が上昇し、その結果、左心房を押すことができる突起自体に加え HHは70歳以上の年齢層で最も一般的である(70%)が、この年齢層はすでにAFになりやすいため、AFとHHの関連は偶然である可能性がある)が、患者の10%のみが40歳未満であることが分かっている。 HHを有することは、年齢に関係なくGERDの症状を悪化または誘発する可能性がある。,
HH患者は、腹腔鏡下NissenまたはBelsey Mark IV眼底形成のいずれかで外科的に治療することができ、手術を完了した患者もAFの症例または症状の減少を有することが観察されている。 これは、HHとAFの間に相関があるという論理的な結論につながる可能性がありますが、それは徹底的に研究され、調査されていません。
決定的ではありませんが、HHおよびGERDの治療が関連するAFを緩和できる理由を正当化するために使用できる二つの可能なメカニズムがあります。, 最初の推測されたメカニズムは非常に巨大なHHの存在であり、直接圧力によって心臓の左心房に影響を与え、心臓への血液供給が減少し、再突入および不整脈につながる可能性のある相対的な虚血を引き起こす可能性がある。 第二のメカニズムは、HH酸逆流によって引き起こされる下部食道の炎症によるものであり、したがってAFにつながる可能性がある(図2)。,
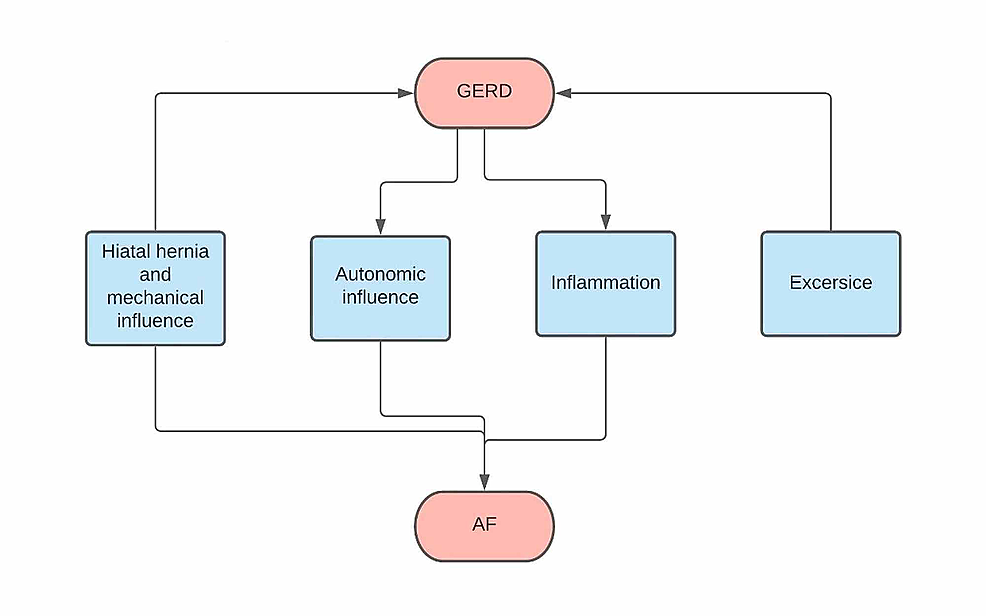
図2:フローチャート
GERD:胃食道逆流症、AF:心房細動
PpiおよびAFに対する影響
以前に議論したように、PpiおよびAFに対するそれらの影響は、gerdの治療は、タンパク質ポンプ阻害剤(ppi)によるものであり、これは常にafおよびその症状の減少をもたらし、発作性af事象の出現を完全に止めることさえできる。, この相関は、酸逆流の効果、およびそれがPPIにどのように反応するか、ならびに発作性AFに対するその効果を中心とすることが決定されている。
PPIが機能するメカニズムは、胃酸の単純な抑制を超えています。 それは胃の粘膜にあるプロトンポンプ(K+H+ATPase)の禁止によって働きます。 それはまた炎症抑制および酸化防止効果によって酸の阻止です。 PPIは抗炎症反応を誘導するだけでなく,細胞レベルでのヒドロキシルラジカル(-OH)産生の抑制を引き起こす(in vitro)。, さらに、PPI治療は、細胞内pH恒常性および組織の調節によって部分的に媒介される内皮細胞、上皮細胞および白血球に対しても抗炎症作用を有すると結 また、タンパク質および転写産物レベルに関して、心臓内に胃K+H+Atpアーゼの機能的に類似したタンパク質が存在することも見出されている。 比較された後、PPIの特異的結合部位は、両方のタイプの組織において類似していることが見出された。, したがって、PPIは、特にGERDの症状によって引き起こされる可能性のあるAFの症状を有する患者の部分に対して、単純な制酸剤よりも体内で機能する抗不整脈および心臓保護剤として作用することが分かった。よりまれに研究されている経路では、GERDがAFの病因を介して自己免疫応答を誘発する可能性があることが注目されている。 自己抗体は単独AF患者においてミオシン重鎖を攻撃する。,あまり一般的ではない別の経路が、GERDおよび虚血性心疾患を有する患者において冠動脈血流が減少する可能性があるという仮説が提唱されている。
この観察により,慢性心房虚血がAFの引き金となり得ると論理的に結論づけることができた。