はじめに
多嚢胞性卵巣症候群(PCOS)は、生殖年齢の女性における内分泌学の最も一般的な疾患の一つである。 PCOSは、オリゴおよび/または無排卵、臨床的および/または生化学的な高アンドロゲン症、および他の病因を排除した多嚢胞性卵巣の超音波特徴(FrおよびTarlatzis、2004)の二つの存在を確認することによって診断される。, PCOSの有病率は、使用される診断基準に依存するが、ロッテルダム診断基準を使用する場合、最大18%になる可能性がある(Rotterdam ESHRE/ASRM主催のPCOS Consensus Workshop Group、2004)。 高アンドロゲン症は、PCOSを有する女性の60-80%に見出される(Azziz et al., 2006). Hyperandrogenismの主要な臨床か生化学的な特徴はアクネ、hirsutism、脱毛症および脂漏性皮膚炎です;高いテストステロン、androstenedioneおよびdehydroepiandrosteroneの硫酸塩のレベル;および減らされた性, この症候群は、生殖症状を呈するだけでなく、インスリン抵抗性、脂質異常症、肥満、2型糖尿病、および全身性炎症を含む代謝的意味も有する(Deugarte et al.,2005;Sartor and Dickey,2005;Escobar-Morreale et al., 2011).
PCOSを有する女性における排卵誘発のための第一選択治療はクエン酸クロミフェン投与であるが、子宮内膜および子宮頸管粘液に対するクエン酸クロミフェンの抗エストロゲン効果は20%の低い受胎率を引き起こすと考えられている(GonenおよびCasper、1990)。, クエン酸クロミフェンはまた、ほてり、乳房不快感、腹部dis満、吐き気、嘔吐、緊張、頭痛、脱毛、および視力障害を含む多くの副作用と関連している(Legro et al.、2007a)。 最近の研究では、インスリン感作剤としてのメトホルミンの役割を調査しており、その使用は増加しているが、そのメカニズムの理解は不完全である(,2007b)。, さらに、それにより可能性としては不満足な処置の結果をもたらす卵巣のhypersstimulation、多数の妊娠および神経管の欠陥のような生来の奇形の危険と共に多数PCOSは多因子代謝-内分泌障害として定義されるので(Laven et al.、2002)、ライフスタイルとダイエット、および特に地中海食は、薬理学的治療と並んで、関連する役割を果たす(Barrea et al., 2019)., 最近の研究では、漢方薬や鍼治療を含む補完的および代替的治療がPCOS症状を緩和する可能性があることが示唆されているが、その有効性および安 したがって、補完的および代替療法を組み込んだ新規治療戦略は、PCOSの治療を最適化するために調査する必要があります。 本研究では、実験室での研究におけるPCOSモデルの治療に使用される漢方薬の効果と基礎となるメカニズムに関するデータをレビューしました。,
メソッド
June30,2018まで英語で公開された記事は、Medline(PubMed経由)およびEMBASE(Elsevier経由)で検索されました。 検索用語は、医学主題見出し(MeSH)用語とその同義語の組み合わせでした。 使用された検索語は次のとおりであった:および。
私たちのレビューの包含基準には以下が含まれていました:
1. PCOSモデルに対する漢方薬の潜在的な影響を評価したin vitroおよびin vivo研究
2., ハーブ、個々のハーブエキス、またはハーブ式の煎じ薬から単離された化合物に関する研究
3. 英語で書かれた記事
除外基準は次のとおりでした。
1. PCOSのための漢方薬の臨床試験
2. レビュー記事
3., 漢方薬の成分を記述していない記事;しかし、これは特許を取られた漢方薬の場合には許可されました
検索された研究の中で、重複を削除した後、タイトルおよび抄録を見直して、潜在的に関連する記事を見つけました。 その後,スクリーニングされた論文の全文をレビューし,包含基準を満たしていることを確認した。,
我々は、ハーブ介入に関するデータを抽出しました;標的細胞(または動物モデル)の使用;ハーブ抽出方法:投与経路;投与量と期間;ハーブ、個々のハーブ抽出物、およびハーブ式の煎じ薬から単離された化合物の結果。 これらのデータに基づいて,PCOSモデルに対する漢方薬の有益な効果の基礎となる作用とメカニズムをまとめた。
結果
研究特性
本レビューでは、PCOSモデルに対する有効性を報告した27の漢方薬を含む22の研究の合計が含まれていました。, 我々は、二つのin vitro研究、22in vivo研究、およびin vitroおよびin vivo実験の両方で三つの研究を同定した。 27の調査の草の介在はハーブ(6つの調査)、九つの個々の草のエキス(11つの調査)、および九つの草の方式の煎じ薬(10つの調査)から隔離される四つの混合物を構成 記事の選択プロセスのフロー図を図1に示します。
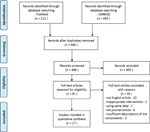
図1スタディ選択プロセスのフロー図。,
ハーブ介入とその実験成果
ハーブから単離された化合物
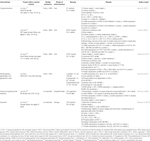
表1ハーブから単離された化合物のin vitroおよびin vivo
個々のハーブエキス
アロエベラ(L.)バーム。総コレステロール(TC)、トリグリセリド(TG)、および低密度リポタンパク質コレステロール(LDL-C)の血漿レベルの低下;高密度リポタンパク質コレステロール(HDL-C)レベル,,2012);正常化された濾胞成長;および発情周期を回復させた(Maharjan et al., 2010). アトラクチロードス-マクロセファラ-コイズ 発情周期の回復およびテストステロンレベル、アンドロステンジオンレベル、遊離アンドロゲン指数、LHレベル、LH/FSH比、および抗ミュラーホルモンレベルの, 2016). Matricaria chamomilla l.処理した雌Wistarラットは,卵巣組織の嚢胞の減少と優性卵胞の数の増加を示した(Zangeneh et al., 2010). ココス-ヌシフェラL., 発情周期を回復し、TC、非常に低密度コレステロールおよびTGレベルを減少させ、HDL-Cレベルを増加させた(Somya et al., 2014). Linumusitatissimum L.処理した雌SDラットは,前庭卵胞および黄体の増加,嚢胞卵胞の数の減少,および前庭卵胞の直径の減少を示した(Jelodar et al., 2018). フォーニクルム-ヴルガレ-ミル 正常な糸球体、正常な基底膜、および毛細血管を誘導した(SadrefozalayiおよびFarokhi、2014)。, Zingiberofficinale Roscoeは、新生児female SDラットにおいてLHおよびエストロゲンのレベルを低下させ、FSHおよびプロゲステロンのレベルを増加させた(Atashpur et al., 2017). 韓国の赤い朝鮮人参(Panaxの朝鮮人参C.A.Mey。)-処理されたSD雌ラットは、卵巣における嚢胞性卵胞およびNGFのmrna発現がより少なかった(Pak et al.,2009;Jung et al., 2011). ラビシア-プミラ(Labisia pumila var. alataは、グルコース注入速度を増強し、TCおよびTGレベルを減少させた(Mannerås et al., 2010). データを表2にまとめます。,
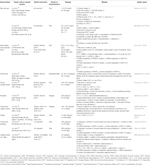
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., 漢方薬(CHM)1(ルートAstragaliルートRehmanniae Preparata、中国LamのCuscuta me、Fruit Lives Lucidi、Fruit Psoraleae、Salviae Miltiorrhizaeの根、およびラズベリーリン)およびCHM2(中国LamのCuscuta me、Fruit Lives Lucidi、およびラズベリーリン)は、発情周期およびLH/FSH比の回復を誘導し、アンドロステンジオンの減少はレベルおよび遊離アンドロゲン指数(Gu et al., 2015)., Gui Zhu Yi Kun式(GZYKF)(精液Cuscutae,Rhizoma Atractylodis Macrocephalae,Angelica sinensis,Adenophora tetraphylla,Plantago asiatica,Rubia cordifolia,Luffa円筒形)は、ベクリン1、軽鎖3、および腫瘍抑制剤p53のmRNA発現を減少させた(Xing et al., 2017). ヘモヒム(Angelica Radix、Cnidii Rhizoma、およびPaeonia Radix)処理SD雌ラットは、黄体の数および大きさの増加および卵巣におけるNGFタンパク質のレベルの減少を示した(Kim et al., 2009). Heqiサンからの削減LHおよびテストステロンレベルを軽減するインスリン抵抗性(Zhao et al., 2017)., 新規ハーブ免疫調節薬(IMOD)(Rosacanina,Urticadioica,およびTanacetumvulgare)処理女性アルビノWistarラットは,卵巣閉鎖および嚢胞性卵胞の発生率が少なく,黄体の数が多かった(Rezvanfarら。, 2012). Kyung-Ok-Ko(KOK)投与は、発情周期の回復と分化のクラスター(CD)11b、CD3、IL-1β、IL-6、TNF-α、IL-8、単球化学誘引タンパク質(MCP)-1、および雌SDラットの卵巣におけるiNOS mRNA発現低下を誘導した(Jang et al.,2014;Lee et al., 2016)., シャオ-ヤオサン(XYS)で処理した雌SDラット(基数bupleuri,angelica,基数paeoniae alba,rhizomaatractylodismacrocephalae,poria,ショウガ,ミント,グリチルリザエ)は嚢胞性ろ胞の数が減少し,前庭性ろ胞における末端デオキシヌクレオチジルトランスフェラーゼdutpニックエンドラベリング(TUNEL)陽性細胞を低下させた(Sunら)。, 2017). データを表3にまとめます。

表3ハーブ式煎じ薬のin vitroおよびin vivo試験(n=10)。,
Pcosを治療するための漢方薬の作用

表4PCOSを治療するための漢方薬の作用。
PCOSに対する作用機序

表5pcosに対する漢方薬の作用機序。,
議論
June30、2018までに発表された文献のレビューは、PCOSモデルの治療のための漢方薬の有効性に関するin vitroおよびin vivo研究の知見をまとめた。 ハーブ(6研究)、ナイン個々のハーブ抽出物(11研究)、およびナインハーブ式煎じ薬(10研究)から単離された四つの化合物の合計は、PCOSに対する阻害効果を有することが, 報告された結果によると,漢方薬は女性ホルモンを正常化し,男性ホルモンを減少させ,発情周期を回復し,インスリン抵抗性を改善し,脂質代謝を改善した。 漢方薬の潜在的な阻害活性は、主に抗炎症性、antiストレス、オートファジーまたはアポトーシスの阻害、および卵巣NGFの減少によって生じる漢方薬の有益な効,
漢方薬はPCOSの炎症状態を阻害することができる
最近の研究では、PCOSの病因および病理をさらに探求している。 科学者たちは、PCOS患者の微小環境において、軽度の慢性炎症が症候群の特徴であることを見出した(Nestler、2000)。 PCOSは慢性炎症に関連している(Benson et al.、2008)、およびマクロファージは、その主要な病因となっている(Wu et al., 2004). 卵巣マクロファージは、卵巣の正常および炎症過程の両方において、サイトカイン、ケモカイン、および成長因子を産生する。, マクロファージは、卵胞形成、排卵、および黄体の形成に関与するアポトーシスおよび組織リモデリングを調整することができる(Benson et al., 2008). PCOSにおけるマクロファージの重要な役割を考えると(Benson et al.、2008)、多くの研究は、PCOS患者の血清中および濾胞液中のサイトカインレベルを比較している。 血清および濾胞液中のTNF-αおよびIL-6レベルは、ゴナドトロフィンで治療された非肥満/非糖尿病PCOS患者で上昇した(Amato et al., 2003)., マクロファージ炎症性タンパク質-1αおよびMCP-1は、PCOS患者で増加し、脂肪過多と関連していた(Glintborg et al., 2009). iNOS、シクロオキシゲナーゼ-2(COX-2)、およびトランスフォーミング成長因子(TGF)-β活性は、PCOS患者の卵巣で増加した(Elia et al.,2006;Hatzirodos et al.、2011)、およびiNOSおよびCOX-2活性は、メトホルミン投与によって防止された(Elia et al., 2006). これらの結果は,免疫系がPCOSの病因に関連していることを示唆した。, したがって、この炎症過程を標的とする新しい治療法は、現在の治療法の治療的代替物となり得る。
このレビューでは、イリドイドはIL-1β、IL-6、IL-10、およびiNOS発現を有意に阻害し、それによって炎症状態を阻害する(Zuo et al., 2017). ケルセチンはまた、IL-1β、IL-6、およびTNF-αのレベルを有意に減少させ、インスリン耐性PCOSラットモデルにおける核因子kappa B(NF-κb)の核転座を減少させた(Wang et al., 2017)., KOKの前投与は、嚢胞と間質のtheca細胞層におけるイオン化カルシウム結合アダプター分子-1(+)マクロファージの発現の増加を減少させた。 KOKはまた、PCOS卵巣組織におけるCD11bおよびCD3のmRNA発現を増加させた。 KOKの前投与は、IL-1β、IL-6、IL-8、TNF-α、MCP-1、およびiNOSのレベルの増加を有意に減少させ、pcos卵巣における表皮成長因子およびTGF-βの減少mRNA発現を増加させた。, これらの結果は、KOKがデヒドロエピアンドロステロン(DHEA)誘導PCOSモデルにおける炎症性メディエーターの発現を調節することを示した(Jang et al., 2014). 炎症メディエーターは、KOK投与によって子宮の子宮内膜においても調節され、これはPCOSモデルにおける子宮内膜過形成を予防することが示されている(Lee et al., 2016). また、血清中のTNF-αおよび卵巣のプロスタグランジンE(PGE)は、Imodsによって減少することが示された(Rezvanfar et al., 2012).,
漢方薬は、PCOSにおける酸化ストレスを減衰させることができます
活性酸素種は、ステロイド形成、卵胞形成、卵母細胞成熟、黄体機能、および黄体分解を含む、女性の生殖における生理学的機能の調節において重要なシグナル分子である(Agarwal et al., 2005). さらに、それらは雌の生殖の病理学的プロセスにおいて重要な役割を果たす(Agarwal et al.,2003;Agarwal et al., 2008)., 酸化ストレスは、身体のantioxidant能力と有毒な酸素および/または窒素由来の生成物との間の平衡が損なわれる状態である。 その結果、遊離基は細胞抗酸化物質によって不十分に解毒されます。 酸化ストレスは雌の生殖において重要な役割を果たす(Ruder et al.,2008;Ruder et al.,2009;Vakilian et al.、2009)、および不妊女性における酸化ストレスマーカーの増加の効果、およびPCOSの病態生理への関与に関する文献が増加している(Joo et al.,2010;Mohamadin et al., 2010)., PCOSは、慢性炎症、酸化ストレス、および異常なマイクロrna発現によって特徴付けられる(Zhao et al.,2015;Zuo et al., 2016). 炎症および酸化ストレスは密接に関連していることが知られているので、酸化ストレスの上昇は、通常、炎症状態から生じ、それにつながる(Zuo et al., 2016). 炎症を酸化ストレスから分離することは困難であり、炎症および酸化ストレスが疾患発生の主要な基礎を構成することが近年提案されている(Duleba and Dokras、2012)。このレビューでは、IMODs(Rezvanfar et al.,,2012)およびiridoids(Zuo et al.,2017)は、主にPCOSラットにおけるフリーラジカルを減少させ、炎症性サイトカインを阻害することによって、直接的または間接的に、酸化/ニトロソストレスに IMODsの投与は大幅に脂質過酸化(酸化ストレスのマーカー)を減少させ、高アンドロゲン性誘発性PCOSにおけるスーパーオキシドジスムターゼ、カタラーゼおよびグルタチオンペルオキシダーゼ(antioxidant電位のマーカー)レベルを増加させた。 さらに,ペルオキシニトライト(ニトロソストレスのマーカー),TNF-αおよびPGEレベルはImodsによって有意に減少した。, さらに、Imodのこれらの効果は組織学的証拠と一致しており、対照群と比較して毛包形成の顕微鏡的特徴が有意に改善された(Rezvanfar et al., 2012). NF-κbシグナル伝達系は、炎症に応答する特定のシグナル伝達分子、遺伝子活性化、および調節タンパク質の支配的なパラダイムとして知られている(Ivanenkov et al., 2011)., イリドイドは、IkBリン酸化レベルの上昇を誘導したリポ多糖を効率的に減衰させ、IkB発現レベルを減少させ、NF-κb P65を減少させ、イリドイドがNF-κb経路, 2017).
漢方薬は、PCOSにおけるアポトーシスおよび/またはオートファジーを調節することができる
顆粒膜細胞の生存または死は、卵胞の運命に影響を与える重要な因子として認識されている(Matsuda et al., 2012). アポトーシスやオートファジーのプログラム細胞死に至ります。, オートファジーは、二重膜小胞であるオートファゴソームが細胞質物質をリソソームに運ぶ過程である(水島-小松、2011)。 顆粒膜細胞においてアポトーシスとオートファジーの両方が誘導され、濾胞発生の制御に関与することが報告されている(Choi et al.,2010;Choi et al., 2013). 顆粒膜細胞は、卵胞の発達において重要なプレーヤーとして認識される。 それらは、卵巣においてエストラジオール、インスリン様成長因子、および他のサイトカインを産生し、エストラジオール、LHおよびFSHの受容体を発現する(Juengel et al.,、2006)、すべてが卵胞の発達の調節に参加している。 従って、granulosaのセルのどの減損でも小胞の無秩序な開発の結果かもしれません。
最後の十年では、オートファジー関連のシグナル伝達経路とその主要なタンパク質調節因子が同定されている。 ラット微小管関連タンパク質1軽鎖3は、オートファゴソーム膜処理に関連している(Kabeya et al., 2000). Beclin-1はまた、オートファゴソーム形成において重要な役割を有することが実証されている(Von Hoven et al., 2012)., さらに、以前の研究では、細胞死または生存の調節におけるオートファジーの二重調節因子として腫瘍抑制因子p53(p53)が同定されている(Vousden and Ryan,2009;Zhang et al., 2010). 低エネルギーレベルでは、p53によって活性化されるアデノシン一リン酸活性化プロテインキナーゼ(AMPK)は、結節性硬化症複合体2を活性化することができ、したがって、ラパマイシン(mTOR)活性の哺乳動物の標的を阻害し、オートファジーを増加させることができる(Feng et al., 2007)., このレビューでは、核内のGZYKFによって活性化されるp53は、今度はampkとセストリンを活性化し、mTOR阻害におけるフィードバックとして作用し、それによってオートファジーを活性化する。 オートファジーは、ホスホイノシチド3-キナーゼ/プロテインキナーゼB(PI3K/Akt)シグナル伝達経路によっても調節される(Pyo et al., 2012). このレビューでは、XYSは、リボソームタンパク質S6キナーゼポリペプチドIおよびAktのリン酸化の減少、ならびに微小管関連タンパク質軽鎖3-Iから微小管関連タンパク質軽鎖3-II変換のin vivoおよびin vitroの両方への増加を軽減した(Sun et al., 2017).,ほとんどのPCOS患者の子宮内膜は厚く、子宮内膜細胞アポトーシスと相関し得る単純な、複雑な、または非定型過形成または悪性形質転換を示す(Villavicencio et al., 2007). DHEAによって誘導される高アンドロゲン症は、子宮内膜中のより多くのアポトーシス細胞と関連しており、メトホルミン(インスリン模倣またはインスリン感作剤)は、アポトーシス細胞の増加した数を減少させることができる(Elia et al., 2009). このレビューでは、アポトーシス細胞死は、TUNEL染色によって評価されました。, 偽またはKOK単独群の子宮組織におけるTUNEL染色によりアポトーシス細胞が検出されることはほとんどなかった。 しかし,DHEA群の子宮内膜ではTUNEL陽性細胞数が増加した。 アポトーシス細胞数の増加はKOK投与後に有意に減少した。 これらの結果による事前管理のコックが抑制されDHEA誘起子宮内膜奇形に対する削減による子宮内膜のアポトーシス(Lee et al., 2016).,
漢方薬はPCOSにおけるNGFのレベルを低下させることができる
これまでの研究では、PCOSがsympathetic神経系の異常な活性化と関連しており、カテコールアミン作動性神経の増加(Semenova、1969)、ノルエピネフリン代謝の障害(Garcia-Rudaz et al.、1998)、および上卵巣神経を介した交感神経の活性の増加(Lara et al., 1993)., 卵巣交感神経支配の発達および機能は、末梢交感神経系発達に必要な標的由来のニューロトロフィンであるNGFの産生のために卵巣に依存する(Levi-Montalcini、1987)。 ニューロトロフィンファミリーは、排卵およびPCOSの病態生理においてNGF受容体およびNGF mRNAを関与させる(Lara et al.,2000;Stener-Victorin et al., 2003). ラット卵巣では、NGFは主として濾胞壁の細胞で合成される(Dissen et al.,,1996)、およびPCOSにおいて、NGFの活性化は、吉草酸エストラジオール(EV)によって誘導される腺へのノルエピネフリン流出の増強に関与する因子であり得る(Lara et al.,2000)PCOSは、sympathetic神経過敏性に関連する高い腹腔内神経線維密度を示す(Stener-Victorin et al., 2003).このレビューでは、ハーブ処方のChangbudodam-TangおよびYongdamsagan-Tangの投与は、脳組織にほとんど影響を与えずに卵巣における上昇したNGFを有意に減少させた(Lee et al., 2003)., HemohimもNGFを正常化し,前庭卵胞数を低下させ,PCOSにおける黄体数を増加させた。 これらの結果は、PCOSの予防および治療におけるHemohimの有益な効果に関する以前の研究の結果と一致している(Pak et al., 2009). さらに、韓国紅参抽出物の投与(Pak et al.,2009;Jung et al.,2011)および韓国紅参総サポニン(Pak et al.、2005)は、EV処理卵巣のものと比較して、NGFタンパク質およびNGF mRNAの発現を有意に減少させた。,
本研究では、PCOSおよびそれに関連する症状を治療するために使用することができる漢方薬のエビデンスをレビューし、この知見は、PCOS治療における生薬の作用機序の臨床医の理解に追加することを目的としている。 我々の研究の主な制限は、介入の異質性である。 さらに、我々の研究は、各研究の品質評価または結果の定量的合成を行わなかった。 方法論的品質評価および結果の定量的合成を含むさらなる研究が保証されている。,
結論
このレビューでは、27の漢方薬を含む22の研究の合計は、PCOSに有益な効果を示した。 27研究におけるハーブ介入は、ハーブ(6研究)、ナイン個々のハーブエキス(11研究)、およびナインハーブフォーミュラ煎じ薬(10研究)から単離された四つの化合物から成 漢方薬は女性ホルモンを正常化し,男性ホルモンを減少させ,発情周期を回復し,インスリン抵抗性を改善し,PCOSにおける脂質代謝を改善することが示された。, PCOSに対する漢方薬の有益な効果の根底にあるメカニズムは、anti症、anti酸化ストレス、オートファジーおよび/またはアポトーシスの阻害、および卵巣NGFの減少に関連している。 漢方薬はPCOSのための有効な治療剤の開発の有望な資源として考慮することができます。
著者の貢献
I-HCとKPがこの研究を設計しました。 C-YKとKPは記事を検索し、データを分析しました。 KPが原稿を書き、I-HCがそれを改訂しました。 すべての著者が記事に貢献し、提出されたバージョンを承認しました。,
資金調達
この作品は、韓国政府(MSIP)によって資金提供された韓国国家研究財団(NRF)助成金によって支援されました(No.NRF-2017R1C1B1006387)と高麗人参の韓国協会(2019)。
利益相反
著者らは、この研究は、潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたと宣言している。,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
ロッテルダムESHRE/ASRM主催のPCOSコンセンサスワークショップグループ(2004)。 多嚢胞性卵巣症候群に関連する診断基準および長期健康リスクに関する2003年のコンセンサスを改訂した。 豊饒の生殖不能症81(1)、19-25。 土井:10.1016/j.fertnstert.2003.10.004
CrossRef Full Text|Google Scholar
Semenova,I.(1969). Stein-Leventhal症候群における卵巣のアドレナリン作動性神経支配。 ヴェストニクAkademii Meditsinskikh Nauk SSSR24(9)、58。
Google Scholar