はじめに
心房細動と心房fl動は2つの一般的な不整脈である。 主に心房細動を示す患者は一般にまた彼らの生命の間に心房fl動を経験します、また逆もまた同様です。,1,2
これらの不整脈は、その根底にある生理学的機序およびそれらの治療のための現在利用可能な治療選択肢が異なるので、それらを明確に区別することが不可欠である。3,4
心房細動と心房fl動の鑑別診断は、心内膜エレクトログラムを使用しても解決が困難な問題を提示することがあります。, これは、例えば、上室性頻脈性不整脈の治療に使用される装置で起こるように、右心房内の単一のカテーテル電極で記録が得られる場合に特に当てはま
本研究の目的は、右心房における単一のカテーテル電極で容易に同定され、心房fl動と組織化された心房細動との間の識別を可能にする電気生理学的パラメータを同定することであった。,
方法
心房細動、典型的な心房fl動、または非定型心房fl動(焦点頻脈は除外された)のアブレーションのための電気生理学的研究を必要とする患者では、24極マッピングカテーテル(Orbiter®、Bard電気生理学) カテーテルを用いて,右心房(外側三尖弁輪および空洞峡)および左心房からの同時双極記録を得た。,
患者は、心房細動のアブレーション(n=32)、典型的な心房flutter(n=81)、および非定型心房flutter(n=15)のために当院に紹介された個人の中から選択された電気生理学的研究の時に治療すべき不整脈を提示したか、または処置中に自発的にまたはプログラムされた刺激を伴う不整脈を発症し、包含基準を満たした人であった。, 心房細動の症例は、少なくとも30秒の期間にわたって右心房記録に組織化された電気パターン(固定され、再現可能なシーケンスとして定義される)と冠洞における無秩序なパターン(断片化された信号、ベースライン心房電図少なくとも150%の持続時間を有する心房記録として定義されるまたは100ms以上の持続時間を有する心房記録として定義される)を表示しなければならなかった(図1)。, 典型的な心房fl動は、記録の12電極に完全に組織化された電気パターンを呈するmacroreentrant不整脈として定義され、プログラムされた刺激を用いて、cavotricuspid isthmusに依存していなかったが、cavotricuspid isthmusに依存していたものとして定義された。
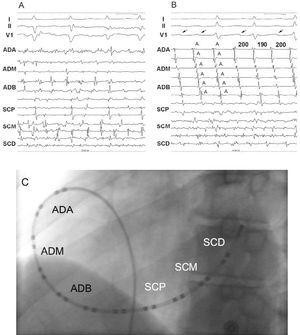
図1. AおよびB:心房細動を有する2人の患者において、表面および心内膜記録を示す。, (A)では両心房に対応するチャネルに不規則および断片化された信号が観察され,(B)では左心房に対応するチャネルに不規則および断片化された信号が右心房に対応するチャネルに組織化された信号とともに見られる。 心電図のV1リード(矢印)には組織化されたパターンが見られる。 C)冠状静脈洞および右心房における24極マッピングカテーテルの位置を示す左前斜め投影。, I、II、V1は、心電図リードを示す;A、心房電図図;HRA、高右心房;MRA、中右心房;LRA、低右心房;PCS、近位冠状洞;MCS、中冠状洞;DCS、遠位冠状洞を示す。
サイクル長は、右心房付属器(徐脈性不整脈または頻脈性不整脈の治療のためのペースメーカーの心房ワイヤ電極が通常位置する)の近くの高い右心房で得られたエレクトログラムにおける各心房周期の変化とともに、3つの連続したバイポーラチャネルにおいて15秒の期間にわたって測定された。, 記録は、可能な限り正確であることを保証するために、400mm/sのチャート速度で得られました。
研究に含まれる患者は、以前の電気生理学的研究を受けておらず、研究の時点で抗不整脈治療を受けていなかった。
統計分析
データは、平均(SD)として表される。 量的変数を分散分析によって比較し、変数間の差を確立するためにBonferroni補正を用いた。,
量的変数のカットポイントを決定するために受信機動作特性曲線を使用した。 曲線下の面積は、95%信頼区間(CI)と共に決定された。 心房fl動の診断における最大感度および特異度について,感度,特異度,正および負の尤度比および正および負の予測値について,試験の基準の妥当性を計算した。 より小さいP値。05は統計的に有意であると考えられた。 統計分析は、WINDOWS用のSPSS(バージョン13.0)を使用して実行されました。,
結果
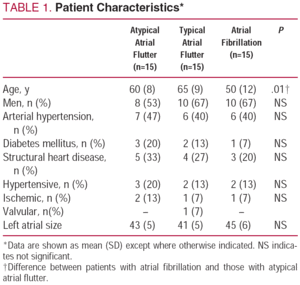
この研究には、合計45人の患者が含まれていました:非定型心房fl動患者15人、典型的な心房fl動患者15人、および心房細動15人。 患者の平均年齢は58(11)歳、28人(62%)が男性、19人(42%)が動脈性高血圧、6人(13%)が糖尿病、12人(27%)が構造性心疾患(7人で高血圧、4人で虚血性、1人で弁膜性)であった。 左心房の平均サイズは43(6)mmであった。, 心房細動を有する患者群で有意に低かった年齢を除いて、3群のベースライン特性に有意差は認められなかった(表)。
典型的および非定型心房flutterの患者は、電気生理学的研究の時点ですでに不整脈を有し、心房細動を有する15人の患者のうち、10人が不整脈を示し、5人がプログラムされた心房刺激によって誘発される持続不整脈(10分以上)を発症した。,
心房細動を有する患者では、すべての症例において右心房の活性化前線は頭蓋側方向にあり、心内膜活性化に安定に関連していた表面心電図中のV1リードでF波が常に認識されていた(図1)。
サイクル長
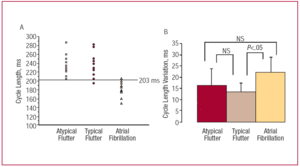
図2. A)心房fl動患者と心房細動を有する患者の両方のグループ間のサイクル長の観点からの差別のためのカットポイント。 B)3つのグループのサイクル長の変化。, CLはサイクル長を示します。
サイクル長の変動
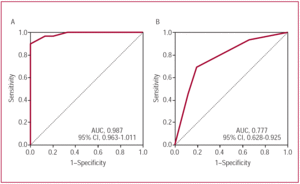
図3. サイクル長(A)およびサイクル長変動(B)に対するレシーバ動作特性曲線。 AUCは曲線の下の面積を示し、CIは信頼区間である。,
サイクル長と変動
心房fl動と心房細動(サイクル長≥203msとサイクル長変動φ18ms)を区別するために両方の基準の組み合わせを使用すると、99%の感度、69%の特異性、26%の陽
議論
主な所見
二つの主要な観察が私たちの研究で行われました。, まず,右心房周期長と心房fl動と心房細動との間のサイクル長変動に有意差があり,組織化されたパターンを呈することが分かった。 サイクル長は心房細動よりも心房fl動の方が大きく、サイクル長の変動は低く、2つのタイプの心房fl動の間に有意差はなかった。 第二に、サイクル長は、心房fl動と心房細動のこのサブセットを区別するためのサイクル長変動よりも優れたパラメータであった。, サイクル長≥203msは、心房fl動と心房細動の間の識別を良好な感度と特異性で可能にし、サイクル長がこのカットポイントを超えると7.25倍の可能性が高く、カットポイントを下回るサイクル長の値が得られたときにこの診断が除外される可能性が25倍高いことが判明した。 試験の感度のわずかな増加は、2つのパラメータを組み合わせたときに観察されたが、これは特異性の有意な減少と関連していた。, その結果、2つの変数の組み合わせの使用は、診断収量を改善しなかった。
このパラメータは、過度に短い間隔を生成し、心房細動の診断の過大評価につながるアーチファクトを含む可能性があるため、分析では最小サイクル長
右心房における組織化された心房細動
現在、心房細動の単純な定義はなく、心電図および電気生理学的記録の両方に適用できる。, 心房細動と心房fl動は、相互に関連している2つの不整脈を表し、異なるメカニズムを介して、それぞれが他の発生に関与することが報告されている。5しかし、両方の不整脈が同じ患者に共存する可能性があり、特に非定型心房fl動または組織化された心房細動を伴う場合、鑑別診断を困難にする。, このタイプの心房細動は、左心房における心内膜活性化の無秩序なパターンと右心房における組織化されたパターンによって特徴付けられ、いくつかの著者6-9によって記述され、我々はこの研究で示されているように。, 心房細動を有する16人の患者を含む症例シリーズでは、心内膜マッピングが右心房および冠状静脈洞の異なる部位で50分にわたって行われたが、Roithingerら9は、その期間の72%までで右心房の小柱領域に組織化された活性化があり、その房の滑らかな壁における時間の19%および冠状静脈洞における時間の51%に過ぎないことを観察した。, しかし、これは心房細動を有する患者の集団で体系的に研究されておらず、その結果、その有病率、臨床的意義、および治療的意味は不明であり、根底にあるメカニズムの明確な説明は利用できない。 一部の患者におけるこの電気的活性化のパターンを説明する一つの可能な仮説は、心房細動を維持するための主要な回路が左心房に位置し、右心房は受動的に活性化されるということである。, この文脈では、心房間伝導が研究されており、それは両方の心房が冠洞の口の周りに位置する伝導の優先ルートを介して互いに通信することが実証されている、卵か、および心房間中隔の前上部領域。10心房fl動の発生に関連する事象と同様に、心房細動の間に観察される右心房における電気的活性化のこのパターンは、crista terminalisを介した機能ブロックの結, Bachmann束および他の優先線維を介して何らかの形で変調された左心房から生じる線維性伝導は組織化され,側壁の頭蓋側方向および右心房の中隔壁の尾頭側方向に組織化された活性化パターンを示すか,またはその逆であり,峡部に依存する心房fl動の活性化パターンを模倣する。11左心房と右心房の間の伝導のこの変調は、O’Donnellらによってある程度研究されている。,12これらの著者らは、心房細動のアブレーションのために参照される患者におけるBachmann束の不応期および伝導時間および冠状静脈洞の口を分析した。 左心房からの減退ペーシング中の不応期およびこれらの構造を通る遅延伝導の両方が対照群よりも心房細動の患者で有意に大きく,これらの構造は各患者で変化する電気生理学的挙動を示すことを示した。,12
臨床的有用性
心房頻脈性不整脈の迅速な検出と心房fl動と心房細動の間の信頼性の高い差別は、心房療法を提供することができるペースメーカーおよび除細動器の使用およびプログラミングのための重要な臨床的意味を持っている。 これらの患者では、心房抗脈脈ペーシングは、研究に応じて、エピソードの30%から50%において有効であると報告されている。,13-15心房不整脈(心房頻脈、心房fl動、心房細動)が相互に関連していることが知られており、この意味で、ペーシング療法の低い相対的有効性は、右心房に植え付けられた単一のカテーテル電極によって心房検出を行う場合、装置によって検出された不整脈の誤った解釈によるものである可能性がある。 これは、検出エラーおよび効果のない治療の原因となる可能性がある。, しかし,臨床的観点からは,心房細動のいくつかのエピソードが抗脈脈ペーシングによって治療されていても,心房fl動のエピソードの有意な検出不足が起こらないように装置をプログラムすることが望ましい。 このアルゴリズムは,右心房に単一のカテーテル電極のみが利用可能な症例における頻脈患者の電気生理学的研究においても実用的であり,心房fl動と組織化された心房細動を迅速に識別できる。,
これまでの研究
心房fl動と心房細動を区別するために、様々な方法が使用されてきた。 これらの方法のいくつかは簡単に適用できます。 Jungら16は28人の患者を研究し、315ms以上の平均サイクル長が心房fl動または心房細動を有する患者から正常洞調律を有する患者を区別し、11.5ms以上のSDが心房fibr動を有する患者から心房細動を有する患者を区別することを見出した。, しかし、その研究では、心房細動のエピソードが右心房からの録音において組織化された活性化パターンを提示したかどうかは特定されなかった。, 他の著者らは、変換を用いた信号間変動の評価と異なるスケールに対するSDの計算、得られた信号の規則性、速度、エネルギー分布などの一連の要素を持つ17ベイズ解析、18QRS複素減算心電図の時間領域解析など、心房fl動と心房細動を区別するために特定のアナライザを使用する必要がある複雑な方法を採用している。,19一般に、これらの提案されたアルゴリズムのすべては、2つの不整脈の間の鑑別診断を得るために適切な診断収量を表示する。 しかし、それらの使用は、分析に必要な時間および特定の技術の必要性のために、本質的に研究用途に限定される。
制限
私たちの研究の主な制限は、心房細動の患者が心房細動のアブレーションのために参照される患者の選択された集団に属することである。, したがって,この結果は心房細動を有する患者の一般集団には適用できない可能性がある。
結論
右心房から記録されたエレクトログラムのサイクル長とサイクル長の変化は、心房fl動と右心房の組織化された心房細動との間で有意に異なり、心房fl動のサイクル長と低いサイクル長の変化であった。 サイクル長>=203ミリ秒は、心房fl動と心房細動との間の識別を可能にし、良好な感度と特異性を有する。, サイクル長の変化は、2つの不整脈を区別する際の診断収量を改善しなかった。