触媒は、化学反応を加速するが、反応によって消費されない物質であり、したがって、触媒は、それがスピードアップ、または触媒するために使用されている反応の終わりに化学的に変化しない状態で回収することができる。

ディスカッション
化学物質が反応するためには、生成物中の結合が反応物中の結合とは異なるため、それらの結合を再配置する必要があります。,結合再配置の最も遅いステップは、遷移状態と呼ばれるものを生成する-反応物でも生成物でもないが、両者の間の中間体である化学種。
遷移状態を形成するためにはエネルギーが必要です。 このエネルギーは活性化エネルギーまたはEaと呼ばれます。下の図を左から右に読むと、反応物が遷移状態を通過して生成物になるときの反応の進行を示しています。,
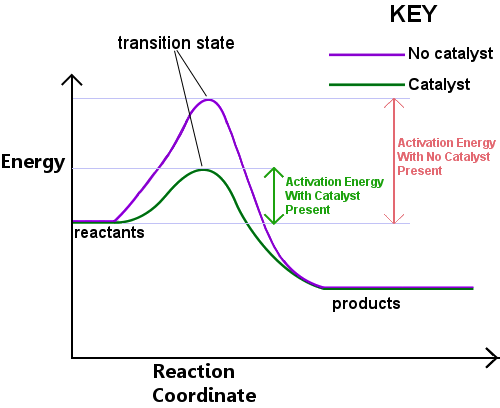
活性化エネルギーは、化学反応に対する障壁、交差しなければならないハードルと考えることができます。障壁が高い場合、衝突し、遷移状態を形成し、障壁を横断するのに十分な運動エネルギーを有する分子はほとんどない。Eaより低いエネルギーの反応物は遷移状態を通過して反応して生成物になることはできません。
触媒は、反応のために、より低いEaを有する異なる経路を提供することによって作用する。 触媒はエネルギー障壁を下げる。,異なる経路により、反応物を生成物に変換するために必要な結合再配置が、より低いエネルギーでより容易に行われるようになりますinput.In 任意の時間間隔で、触媒の存在は、反応物種のより大きな割合が遷移状態を通過して生成物になるのに十分なエネルギーを拾うことを可能にする。
例1:ハーバープロセス
水素と窒素からアンモニアを作るために使用されるハーバープロセスは、反応物体結合がより容易に転位して遷移状態を形成する原子サイトを提供する鉄によって触媒される。,
例2:酵素
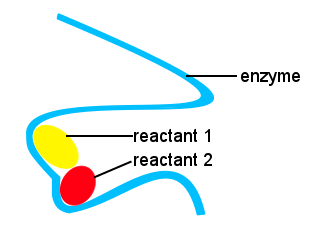
私たちの体や他の生き物では、酵素は生化学反応をスピードアップするために使用されます。 酵素は触媒の一種です。適切な速度で反応を起こすことを可能にする酵素なしでは、複雑な生命は不可能であろう。反応物に結合する酵素の位置と共に酵素の形は代わりとなる反作用の道を提供し、減らされた活発化エネルギー障壁との遷移状態を形作るために,
以下の概略図において、長鎖酵素は、反応物分子が一緒になって低い活性化エネルギーで遷移状態を形成するための部位を提供する。
触媒は、化学平衡の位置をシフトすることはできません-平衡定数Keqが変化しないように、前方および後方の反応は両方とも加速されます。しかし、除去により製品に反応混合物から、総合金の製品を形成できる実際の増加が見込まれます。