Johdanto
munasarjojen Monirakkulatauti (PCOS) on yksi yleisimmistä häiriöt endokrinologia hedelmällisessä iässä olevia naisia. PCOS on diagnosoitu vahvistaa läsnäolo kaksi seuraavista: oligo – ja/tai anovulaatio, kliininen ja/tai biokemiallisten hyperandrogenismi, ja ultraääni ominaisuudet monirakkulatauti munasarjat, lukuun ottamatta muita etiologies (Fr ja Tarlatzis, 2004)., Esiintyvyys hinnat PCOS riippuu diagnostisia kriteerejä, mutta ne voivat olla jopa 18%, kun käytät Rotterdam diagnostiset kriteerit (Rotterdam ESHRE/ASRM-Sponsoroi PCOS Konsensus Työpaja Ryhmä, 2004). Hyperandrogenismia esiintyy 60-80 prosentilla naisista, joilla on PCOS (Azziz et al., 2006). Tärkeimmät kliiniset tai biokemialliset ominaisuudet hyperandrogenismi ovat akne, hirsutismi, hiustenlähtö, ja seborrooinen ihottuma, kohonnut testosteroni, androsteenidionin, ja dehydroepiandrosterone sulfaatti tasoilla; ja laski sukupuolihormonien sitova globuliini (SHBG) tasot., Oireyhtymä ei vain esittelee lisääntymis ilmenemismuotoja mutta on myös metabolisia vaikutuksia, kuten insuliiniresistenssi, dyslipidemia, lihavuus, tyypin 2 diabetes, ja systeeminen tulehdus (Deugarte et al., 2005; Sartor and Dickey, 2005; Escobar-Morreale ym., 2011).
Kun taas ensilinjan hoito ovulaation naisilla PCOS on clomiphene sitraatti hallinto, antiestrogenic vaikutukset clomiphene sitraatti on kohdun limakalvon ja kohdunkaulan liman uskotaan aiheuttaa alhainen käsitys osuus 20% (Gonen ja Casper, 1990)., Clomiphene sitraatti liittyy myös useita haittavaikutuksia, kuten kuumia aaltoja, rintojen kipua, vatsan turvotus, pahoinvointi, oksentelu, hermostuneisuus, päänsärky, hiustenlähtö, ja näköhäiriöitä (Legro et al., 2007a). Viimeaikaiset tutkimukset ovat tutkineet rooli metformiinin kuten insuliini-herkistävä aine, ja vaikka sen käyttö on lisääntymässä, ymmärrystä sen mekanismi on epätäydellinen (Legro et al., 2007b)., Lisäksi, se voi aiheuttaa kehityksen useita munarakkuloita, sekä riskiä munasarjojen hyperstimulaatio, useita raskauksia, ja synnynnäisiä epämuodostumia, kuten hermostoputken vikoja, mikä johtaa mahdollisesti epätyydyttäviä hoitotuloksia.
Koska PCOS on määritelty monitekijäinen aineenvaihdunnan-hormonitoimintaa häiriö (Laven et al., 2002), elämäntapa ja ruokavalio ja Välimeren ruokavalio, erityisesti, pelata merkittävä rooli rinnalla lääkehoitoa (Barrea et al., 2019)., Viimeaikaiset tutkimukset ovat osoittaneet, että täydentäviä ja vaihtoehtoisia hoitomuotoja, kuten rohdosvalmisteita ja akupunktio voi lievittää PCOS oireita, mutta näyttöä niiden tehosta ja turvallisuudesta on riittävästi. Siksi romaani hoidon strategiat sisältävät täydentäviä ja vaihtoehtoisia hoitoja on tutkittava optimoida hoitoon PCOS. Tässä tutkimuksessa tarkastelimme laboratoriotutkimuksissa PCOS-mallin hoidossa käytettävien kasviperäisten lääkkeiden vaikutuksia ja niiden taustalla olevia mekanismeja koskevia tietoja.,
Menetelmiä
Artikkelit julkaistaan englanniksi jopa 30. kesäkuuta 2018 oli etsinyt Medline kautta (PubMed) ja EMBASE (via Elsevier). Hakusanat olivat yhdistelmä lääketieteen subjektin nimikkeitä (MeSH) ja niiden synonyymejä. Hakusanat olivat seuraavat: ja .
kriteereillä meidän arvostelu kuului seuraavasti:
1. In vitro-ja in vivo tutkimukset, jotka arvioidaan mahdolliset vaikutukset kasviperäisten lääkkeiden PCOS malli
2., Tutkimus yhdisteitä eristetty yrteistä, yksittäisten yrttiuutteet, tai kasviperäisten kaava decoctions
3. Englanniksi kirjoitetut artikkelit
poissulkemisperusteet olivat seuraavat:
1. Kliinisissä tutkimuksissa rohdosvalmisteita PCOS
2. Review articles
3., Artikkelit, joita ei kuvata komponentit kasviperäisten lääketiede; kuitenkin, tämä on sallittua siinä tapauksessa, patentoitu rohdosvalmisteita
Joukossa haettuja tutkimuksia, kun poistat kaksoiskappaleita, otsikot ja tiivistelmät tarkistettiin löytää mahdollisesti asiaan artikkeleita. Sitten seulottujen artikkelien koko teksti tarkistettiin sen varmistamiseksi, että ne täyttivät sisällyttämiskriteerimme.,
Olemme uuttaa tietoa kasviperäisten interventio; kohdesolun (tai eläin-malli) käyttö; menetelmä kasviperäisten louhinta: route of administration; annostus ja aikoja, ja tulokset yhdisteitä eristetty yrteistä, yksittäisten yrttiuutteet, ja kasviperäisten kaava decoctions. Näiden tietojen perusteella tiivistimme kasvirohdosvalmisteiden suotuisien vaikutusten taustalla olevat toimet ja mekanismit PCOS-malliin.
Tulokset
Tutkimus Ominaisuudet
Tässä tarkastelussa, olemme mukana yhteensä 27 tutkimuksessa, joihin osallistui 22 rohdosvalmisteita, jotka ilmoitetaan niiden tehoa on PCOS malli., Tunnistimme kaksi in vitro-tutkimusta, 22 in vivo-tutkimusta ja kolme tutkimusta sekä in vitro-että In vivo-kokeilla. Kasviperäisten interventiot 27 opintoihin kuului neljä yhdisteitä eristetty yrttejä (6 tutkimusta), yhdeksän yksittäisten yrttiuutteet (11 tutkimusta), ja yhdeksän kasviperäisten kaava decoctions (10 tutkimusta). Artikkelin valintaprosessin vuokaavio esitetään kuvassa 1.
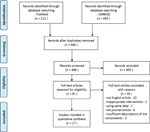
Kuva 1. kaavio tutkimuksen valinta prosessi.,
Kasviperäisten Interventiot ja Niiden Laboratorio Tulokset
Yhdisteitä Eristetty Yrteistä
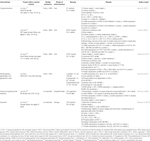
Taulukossa 1 on In vitro-ja In vivo-tutkimukset yhdisteitä, eristetty yrttejä (n=6).
Yksittäiset yrttiuutteet
Aloe vera (L.) Burm.f. vähentää plasman yhteensä kolesteroli (TC), triglyseridien (TG), ja ldl-kolesteroli (LDL-C); kohottaa hdl-kolesteroli (HDL-C) tasot (Desai et al.,, 2012); normalisoitu follikulaarinen kasvu; ja talteen kiima-ajan (Maharjan et al., 2010). Atractylodes macrocephala Koidz. aiheuttama elpyminen kiimasykliä ja vähentää testosteronitasoja, androsteenidionin, free androgen index, LH tasoja, LH/FSH-suhde, ja anti-Mullerian hormoni tasot (Zhou et al., 2016). Matricaria chamomilla L.-käsitelty naisten Wistar rotilla osoitti vähentynyt kystat, munasarjojen kudosta ja lisääntynyt määrä määräävän munarakkuloita (Zangeneh et al., 2010). Cocos nucifera L., talteen kiima-ajan; vähentynyt TC, hyvin alhainen kolesteroli ja TG tasot; ja lisääntynyt HDL-C tasot(Soumya et al., 2014). Linum usitatissimum L.-käsitelty naisten SD rotilla lisääntynyt antrumin munarakkuloiden ja keltarauhasen, vähentynyt määrä kystinen follicles, ja vähentää halkaisija antral munarakkuloita (Jelodar et al., 2018). Foeniculum vulgare Mill. aiheuttama normaali glomerulus, normaali kellarissa kalvo, ja kapillaareja (Sadrefozalayi ja Farokhi, 2014)., Zingiber officinale Roscoe alensi tasoja LH ja estrogeenin, ja lisääntynyt taso FSH: n eikä progesteronin vastasyntyneiden naisten SD-rottia (Atashpour et al., 2017). Korean punainen ginseng (Panax ginseng C. A. Mey.) hoidetuilla naarasrotilla kystinen follikkeli ja NGF: n mRNA-ilmentymä munasarjoissa (Pak et al., 2009; Jung et al., 2011). Labisia pumila var. alata paransi glukoosi-infuusionopeutta ja alensi TC-ja TG-pitoisuuksia (Mannerås ym., 2010). Tiedot on koottu taulukkoon 2.,
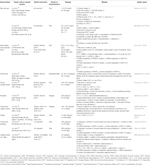
Table 2 In vitro and in vivo studies of individual herbal extracts (n=11).
Herbal Formula Decoctions
Bushen Tongmai recipe (composed of Astragalus membranaceus Bge, Radix Polygoni Multiflori, Herba Cistanches, Radix Salviae Miltiorrhizae, Radix Notoginseng, Radix Puerariae, Herba Epimedii, Rhizoma Chuanxiong, and Radix Rehmanniae) reduced serum fasting insulin and enhanced protein expression of Protein kinase Bα in thecal and granulosa cells of antral follicles (Li et al., 2010)., SD rats treated with Changbudodam-Tang (Rhizoma atractylodis, Rhizoma cyperi, Fructus ponciri, Pericarpium citri nobilis, Poria, Arisaematis Rhizoma, Radix glycyrrhizae, Massa Medicata Fermentata, and Zingiberis Rhizoma) and Yongdamsagan-Tang (Radix gentianae, Bupleuri Radix, Alimatis Rhizoma, Lignum akebiae, Plantaginis Semen, Hoelen, Rehmanniae Radix, Angelicae Gigantis Radix, Gardeniae Fructus, Scutellariae Radix, and Radix glycyrrhizae) showed a reduced number of cystic follicles, a higher number of growing secondary follicles, and reduced expression of NGF in ovaries (Lee et al., 2003)., Kiinan kasviperäisten lääkeaineiden (CHM) 1 (Root Astragali Root Rehmanniae Preparata, Cuscuta minua kiinalaisen Lam, Hedelmiä Asuu Lucidi, Hedelmiä Psoraleae, Juuri Salviae Miltiorrhizae, ja vadelma Linn) ja CHM 2 (Cuscuta minua kiinalaisen Lam, Hedelmiä Asuu Lucidi, ja vadelma Linn) aiheuttama recovery kiimasykliä ja LH/FSH-suhde, ja vähentäminen androsteenidionin pitäisi tasoilla ja vapaan androgeenin indeksi (Gu et al., 2015)., Gui Zhu Yi Kunin kaava (GZYKF) (Siemenneste Cuscutae, Rhizoma Atractylodis Macrocephalae, Angelica sinensis, Adenophora tetraphylla, Plantago asiatica, Rubia cordifolia, ja Luffa lieriömäinen) vähentää mRNA ilmaisuja Beclin 1, light chain 3, ja p53-tuumorisuppressorin (Xing ym., 2017). HemoHIM (Radix Angelica, Cnidii Rhizoma, ja Paeonia Radix)-hoitoa SD-naaras rotilla lisääntynyt määrä ja koko keltarauhasten ja laski tasolle NGF proteiinia munasarjat (Kim et al., 2009). Heqi Sanin havaittiin vähentävän LH-ja testosteronitasoja sekä vähentävän insuliiniresistenssiä (Zhao et al., 2017)., Romaani kasviperäisten immunomodulaattori lääke (IMOD) (Rosa canina, Urtica dioica, ja Tanacetum vulgare)-hoitoa naaras albiino Wistar rotilla osoitti, vähemmän ilmaantuvuus munasarjojen atretic ja kystinen follicles, ja suurempi keltarauhasten määrä (Rezvanfar et al., 2012). Kyung-Ok-Ko (KOK) hallinto aiheuttama elpyminen kiimasykliä ja klusterin eriyttäminen (CD)11b, CD3, IL-1β, IL-6, TNF-α, IL-8, monosyytti chemoattractant protein (MCP)-1, ja lisää mRNA: n ilmentymisen väheneminen munasarjat naisten SD-rottia (Jang et al., 2014; Lee et al., 2016)., Naisten SD-rottia hoidettiin Xiao Yao-San (XYS) (radix bupleuri, angelica, radix paeoniae alba, rhizoma atractylodis macrocephalae, poria, inkivääri, minttu, ja glycyrrhizae) osoitti, pienempi määrä kystinen munarakkuloita ja alensi terminaali deoxynucleotidyl transferaasin dUTP nick end merkintöjä (TUNEL) positiivisia soluja antral munarakkuloita (Sun et al., 2017). Tiedot on koottu taulukkoon 3.

Taulukko 3 In vitro-ja In vivo-tutkimukset kasviperäisten kaava decoctions (n=10).,
Toimia Rohdosvalmisteita Hoitoon PCOS

Taulukossa 4 on toimia rohdosvalmisteita hoitoon PCOS.
vaikutusmekanismit PCOS

Taulukko 5 vaikutusmekanismit kasviperäisten lääkkeiden PCOS.,
Keskustelua
– Meidän kirjallisuuskatsaus julkaistiin jopa 30. kesäkuuta 2018 tiivistää tulokset in vitro-ja in vivo-tutkimukset tehosta rohdosvalmisteita hoitoon PCOS malli. Yhteensä neljä yhdisteitä eristetty yrttejä (6 tutkimusta), yhdeksän yksittäisten yrttiuutteet (11 tutkimusta), ja yhdeksän kasviperäisten kaava decoctions (10 tutkimusta) havaittiin olevan estävä vaikutus PCOS., Tulosten mukaan todettu, kasviperäisten lääkkeiden normalisoida naisten hormonit, vähentynyt mies hormoneja, talteen kiimasykliä, parantaa insuliiniresistenssiä ja parantaa rasva-aineenvaihduntaa. Huomasimme, että mahdolliset estävä aktiivisuus kasviperäisten lääkkeiden voi vaikuttaa eri näkökohtia PCOS, jolla on myönteisiä vaikutuksia kasviperäisten lääkkeiden, jotka johtuvat pääasiassa anti-tulehdus, anti-oksidatiivisen stressin, esto autophagy tai apoptoosin, ja munasarjojen NGF vähentäminen.,
Rohdosvalmisteita Voi Estää tulehdukset PCOS
Viimeaikaiset tutkimukset ovat tarkemmin etiologia ja patologia PCOS. Tutkijat havaitsivat, että PCOS-potilaiden mikroympäristössä lievä krooninen tulehdus on oireyhtymän tunnusmerkki (Nestler, 2000). PCOS: llä on ollut merkitystä kroonisessa tulehduksessa (Benson et al., 2008), ja makrofagit ovat olleet sen merkittävä patogeneesi (Wu et al., 2004). Munasarjamakrofagit tuottavat sytokiineja, kemokiineja ja kasvutekijöitä sekä munasarjan normaaleissa että tulehduksellisissa prosesseissa., Makrofagit voivat orkestroida apoptoosin ja kudosmuutoksen, jotka osallistuvat follikulogeneesiin, ovulaatioon ja keltarauhasen muodostumiseen (Benson et al., 2008). Koska makrofagien kriittinen rooli PCOS: ssa (Benson et al., 2008), lukuisissa tutkimuksissa on verrattu sytokiinipitoisuuksia seerumissa ja follikulaarisissa nesteissä PCOS-potilailla. TNF-α ja IL-6-pitoisuudet seerumissa ja follikulaarinen nesteet olivat koholla ei-lihavia/ei-diabeetikko PCOS potilailla gonadotropiinien (Amato et al., 2003)., Makrofagi-inflammatorinen proteiini-1α-ja MCP-1 lisättiin PCOS-potilaiden ja liittyvät painoindeksin (Glintborg ym., 2009). lisää, syklo-oksigenaasi-2 (COX-2), ja muuttamassa kasvutekijä (TGF)-β-aktiivisuus oli lisääntynyt munasarjat PCOS-potilailla (Elia ym., 2006; Hatzirodos ym., 2011), ja inos-ja COX-2-aktiivisuutta estettiin metformiinin annolla (Elia et al., 2006). Nämä tulokset viittaavat siihen, että immuunijärjestelmä on merkityksellinen PCOS: n patogeneesin kannalta., Siksi uusia korjaustoimenpiteitä kohdistaminen tämä tulehduksellinen prosessi voi olla terapeuttinen vaihtoehto nykyinen hoito.
tässä tarkastelussa, iridoids merkittävästi estyy IL-1β, IL-6, IL-10, ja lisää ilmaisun, mikä rajoitti tulehdukset (Zuo et al., 2017). Quercetin myös merkittävästi vähentää tasoa IL-1β, IL-6 ja TNF-α, ja laski ydinvoiman translokaatio of nuclear factor kappa B (NF-kB) ja insuliini-resistenssi PCOS rotta malli (Wang et al., 2017)., Pre-hallinnon KOK vähentynyt lisääntynyt ilmaus ionisoitua kalsiumia sitovan adapter molekyyli -1 (+) makrofagit kotelo-solujen kerros kystat ja stroomaan. KOK lisäsi myös cd11b: n ja CD3: n mRNA-ilmentymistä PCOS-munasarjakudoksessa. Pre-hallinnon KOK vähentynyt merkittävästi kohonneita IL-1β, IL-6, IL-8, TNF-α, MCP-1, ja lisää, ja lisääntynyt vähentynyt mRNA ilmaisun epidermaalinen kasvutekijä ja TGF-β PCOS munasarjat., Nämä tulokset osoittivat, että KOK säätelee ilmaus tulehdusvälittäjäaineiden vuonna dehydroepiandrosterone (DHEA) aiheuttama PCOS malli (Jang et al., 2014). Tulehdusvälittäjäaineiden olivat myös säännelty limakalvon kohtu, jonka KOK hallinto, joka on osoitettu estää kohdun limakalvon liikakasvu PCOS mallit (Lee et al., 2016). Lisäksi osoitettiin, että imodit (Rezvanfar et al., 2012).,
Rohdosvalmisteita Voi Lievittää Oksidatiivisen Stressin PCOS
Reaktiivisia hapen lajeja ovat tärkeä signaali molekyylejä sääntelyn fysiologisia toimintoja naisten lisääntymiseen, kuten steroidien, follikulogeneesissä, munasolun kypsymisen, keltarauhasen toiminto, ja luteolysis (Agarwal et al., 2005). Lisäksi niillä on keskeinen rooli naisten lisääntymisen patologisissa prosesseissa (Agarwal et al., 2003; Agarwal ym., 2008)., Oksidatiivinen stressi on tila, jossa tasapaino antioksidantti kapasiteetti kehon ja myrkyllisiä hapen – ja/tai typen johdetut tuotteet on heikentynyt. Näin ollen vapaita radikaaleja ei ole riittävästi myrkytetty solujen antioksidanteilla. Oksidatiivisella stressillä on tärkeä rooli naaraiden lisääntymisessä (Ruder et al., 2008; Ruder et al., 2009; Vakilian et al., 2009), ja on yhä enemmän kirjallisuuden vaikutuksista lisääntynyt oksidatiivisen stressin merkkiaineiden hedelmättömiä naaraita, ja niiden osallistumista patofysiologia PCOS (Joo et al., 2010; Mohamadin et al., 2010)., PCOS on ominaista krooninen tulehdus, oksidatiivinen stressi ja epänormaalia microRNA ilmaus (Zhao et al., 2015; Zuo ym., 2016). Koska tiedetään, että tulehdus ja oksidatiivinen stressi ovat tiiviisti sidoksissa toisiinsa, kohonnut oksidatiivista stressiä yleensä tuloksia, ja johtaa, tulehduksellinen sairaus (Zuo et al., 2016). Se on vaikea erottaa tulehdusta, oksidatiivista stressiä, ja se on ehdotettu viime vuosina, että tulehdusta ja oksidatiivista stressiä käsittää tärkein perusta taudin esiintyminen (Duleba ja Dokras, 2012).
tässä arvostelussa IMODs (Rezvanfar et al.,, 2012) ja iridoidit (Zuo et al., 2017) osoitti positiivisia vaikutuksia oksidatiiviseen/nitrosatiiviseen stressiin joko suoraan tai epäsuorasti, pääasiassa vähentämällä vapaita radikaaleja ja estämällä tulehduksellisia sytokiineja PCOS-rotilla. Hallinto IMODs merkittävästi vähentää lipidiperoksidaation (merkki oksidatiivista stressiä) ja lisääntynyt superoksididismutaasi, katalaasi ja glutationiperoksidaasi (markkereita antioksidantti potentiaalia) tasoa hyperandrogenismi aiheuttama PCOS. Lisäksi Imodit vähensivät merkittävästi peroksinitriitin (nitrosatiivisen stressin merkkiaine), TNF-α: n ja PGE: n pitoisuuksia., Lisäksi, nämä vaikutukset IMODs olivat yhdenmukaisia histologista näyttöä, joka osoitti merkittävää parannusta mikroskooppiset ominaisuudet follikulogeneesissä verrattuna kontrolliryhmään (Rezvanfar et al., 2012). NF-kB signalointi järjestelmä tunnetaan hallitseva paradigma tietyn signaalin transduktio molekyylejä, geenin aktivointi, ja säätelyproteiinit vastaus tulehdus (Ivanenkov et al., 2011)., Se iridoids tehokkaasti heikennetyt lipopolysakkaridin aiheuttama korkeus IkB: n fosforylaation tasoilla, vähentynyt IkB ilmaisun tasoa, ja laski NF-kB P65, mikä osoittaa, että iridoids käyttää niiden antioksidantti vaikutuksia kautta NF-kB-reitin (Zuo et al., 2017).
Rohdosvalmisteita Voi Säädellä Apoptoosin ja/tai Autophagy PCOS
survival tai kuolema granuloosasoluissa on tunnustettu kriittinen tekijä, joka vaikuttaa kohtalo munarakkuloita (Matsuda ym., 2012). Apoptoosi ja autofagia ovat kaksi ohjelmoidun solukuoleman muotoa., Autophagy on prosessi, jossa on autophagosome, joka on kaksinkertainen kalvo, rakkula, kuljettaa sytoplasman materiaalia lysosome (Mizushima ja Komatsu, 2011). Se on raportoitu, että sekä apoptoosin ja autophagy voidaan indusoida granuloosasoluissa, ja että he ovat mukana valvonnassa follikkelien kehittymistä (Choi et al., 2010; Choi et al., 2013). Granulosasolut tunnistetaan follikkelien kehittymisen kannalta kriittisiksi toimijoiksi. Ne tuottavat estradiolia, insuliinin kaltaisia kasvutekijöitä ja muita sytokiineja munasarjoissa ja ilmentävät estradiolin, LH: n ja FSH: n reseptoreita (Juengel et al.,, 2006), jotka kaikki osallistuvat sääntelyn juuret kehitykseen. Näin ollen mikä tahansa granulosa-solujen vajaatoiminta voi johtaa follikkeleiden häiriintyneeseen kehittymiseen.
viime vuosikymmenen aikana, autophagy liittyvien signalointireittien ja niiden suuret proteiinia sääntelyviranomaisten on tunnistettu. Rotan mikrotubulukseen liittyvä proteiini 1: N Kevyt ketju 3 liittyy autofagosomin kalvonkäsittelyyn (Kabeya et al., 2000). Beclin-1: llä on myös osoitettu olevan kriittinen rooli autofagosomien muodostumisessa (Von Hoven et al., 2012)., Lisäksi aiemmissa tutkimuksissa on havaittu, että p53-tuumorisuppressorin (p53) kuin dual modulaattori autophagy säätelyssä solun kuoleman tai eloon (Vousden ja Ryan, 2009; Zhang et al., 2010). Alhainen energian tasoilla, adenosiinimonofosfaatin-aktivoitu proteiinikinaasi (AMPK), joka aktivoituu p53, voi aktivoida mukulakasvit tauti monimutkainen 2, ja näin ollen estää nisäkkään rapamysiinin (mTOR) toimintaa ja lisätä autophagy (Feng et al., 2007)., Tässä tarkastelussa, p53, joka aktivoituu GZYKF ydin puolestaan aktivoitu AMPK ja sestrin, toimii palautteen mTOR esto, aktivoiden autophagy. Autophagy on myös mukauttaa phosphoinositide 3-kinaasi/proteiinikinaasi B (PI3K/Akt) signalointireitteihin (Pyo et al., 2012). Tässä tarkastelussa, XYS lievittää vähentäminen fosforylaatiota ribosomaalisen proteiinin S6 kinaasi polypeptidi minä ja Akt, sekä lisätä microtubule-associated protein light chain 3-I microtubule-associated protein light chain 3-II muuntaminen sekä in vivo ja in vitro (Sun et al., 2017).,
endometria useimmat PCOS-potilailla on paksu ja näyttely yksinkertainen, monimutkainen, tai epätyypillinen hyperplasia tai pahanlaatuinen muutos, joka saattaa korreloida kohdun limakalvon solujen apoptoosin (Villavicencio et al., 2007). Hyperandrogenismi aiheuttama DHEA on liittynyt suurempi määrä apoptoottisten solujen endometria, ja metformiini (an insulinomimetic tai insuliini-herkistävä aine) voi vähentää lisääntynyt määrä apoptoottiset solut (Elia ym., 2009). Tässä katsauksessa apoptoottinen solukuolema arvioitiin TUNEL-värjäyksellä., Apoptoottisia soluja havaittiin harvoin TUNEL-värjäytymällä sham-Tai KOK-yksin-ryhmän kohtukudoksessa. Tunel-positiivisten solujen määrä kuitenkin kasvoi DHEA-ryhmän endometriassa. Apoptoottisten solujen määrän kasvu väheni merkittävästi Kokin annon jälkeen. Nämä tulokset osoittavat, että pre-hallinnon KOK esti DHEA aiheuttama kohdun epämuodostuma vähentämällä kohdun limakalvon apoptoosin (Lee et al., 2016).,
Rohdosvalmisteita Voi Alentaa NGF PCOS
Aiemmat tutkimukset ovat osoittaneet, että PCOS liittyy epänormaali sympaattisen hermoston, mikä lisää catecholaminergic hermoja (Semenova, 1969), heikentynyt noradrenaliinin aineenvaihduntaa (Garcia-Rudaz et al., 1998), ja lisäsi sympaattisten hermojen toimintaa ylivoimaisen munasarjahermon kautta (Lara et al., 1993)., Kehitys ja toiminta munasarjojen sympaattinen hermotuksen riippuu munasarja tuotantoon NGF, kohde-johdettu neurotrofiini tarvitaan perifeerisen sympaattisen järjestelmän kehittäminen (Levi-Montalcini, 1987). Se neurotrofiini perhe, syytöksiä NGF-reseptorin ja NGF: n mRNA ovulaation ja patofysiologia PCOS (Lara ym., 2000; Stener-Victorin ym., 2003). Rotan munasarjoissa NGF syntetisoidaan pääasiassa follikulaarisen seinämän soluissa (Dissen et al.,, 1996), ja PCOS, aktivointi NGF voi olla tekijä, joka on mukana parantaa noradrenaliinin ulosvirtaus rauhanen, joka on aiheuttama estradiol valerate (EV) (Lara ym., 2000) PCOS näyttelyitä korkea intraovarian hermo kuitua tiheys, joka liittyy sympaattisen supistumisherkkyyttä (Stener-Victorin et al., 2003).
tässä tarkastelussa, hallinto kasviperäisten kaavoja Changbudodam-Tang ja Yongdamsagan-Tang vähentynyt merkittävästi kohonnut NGF munasarjat, joilla vähän vaikutusta aivojen kudoksen (Lee et al., 2003)., HemoHIM myös normalisoitu NGF, alensi suuri määrä antral munarakkuloita, ja lisääntynyt keltarauhasten määrä PCOS. Nämä tulokset ovat yhdenmukaisia aiempien tutkimusten myönteisiä vaikutuksia HemoHIM ehkäisyyn ja hoitoon PCOS (Pak et al., 2009). Lisäksi Korean punaisen ginseng-uutteen (Pak et al., 2009; Jung et al., 2011) ja Korean punainen ginseng yhteensä saponiinit (Pak et al., 2005) vähensi merkittävästi NGF-proteiinin ja NGF mRNA: n ilmentymistä verrattuna EV-hoitoa saaneisiin munasarjoihin.,
Tämä tutkimus tarkasteli todisteita kasviperäisiä lääkkeitä, jotka voidaan käyttää hoitoon PCOS ja siihen liittyvät oireet ja löydökset on tarkoitus lisätä kliinikot mekanismien ymmärtämistä toiminta rohdosvalmisteita PCOS hoitoon. Tutkimuksemme suurin rajoitus on interventioiden heterogeenisyys. Lisäksi tutkimuksemme ei suorittanut kunkin tutkimuksen laatuarviointia tai tulosten kvantitatiivista synteesiä. Lisätutkimukset, joihin sisältyy metodologinen laadunarviointi ja tulosten kvantitatiivinen synteesi, ovat aiheellisia.,
Johtopäätös
tässä tarkastelussa, yhteensä 27 tutkimuksessa, joihin osallistui 22 rohdosvalmisteita esillä myönteisiä vaikutuksia PCOS. Kasviperäisten interventiot 27 opintoihin kuului neljä yhdisteitä eristetty yrttejä (6 tutkimusta), yhdeksän yksittäisten yrttiuutteet (11 tutkimusta), ja yhdeksän kasviperäisten kaava decoctions (10 tutkimusta). Rohdosvalmisteita olivat osoittaneet, normalisoida naisten hormonit, vähentää mies hormoneja, palauttaa kiimasykliä, parantaa insuliiniresistenssiä ja parantaa rasva-aineenvaihduntaa PCOS., Mekanismit taustalla myönteisiä vaikutuksia kasviperäisten lääkkeiden PCOS liittyvät anti-tulehdus, anti-oksidatiivisen stressin, esto autophagy ja/tai apoptoosin, ja munasarjojen NGF vähentäminen. Rohdosvalmisteita voidaan pitää lupaavana resursseja kehittää tehokkaita terapeuttisia aineita PCOS.
Tekijäosuudet
i-HC ja KP suunnittelivat tutkimuksen. C-YK ja KP tutkivat artikkelit ja analysoivat tiedot. KP kirjoitti käsikirjoituksen ja I-HC tarkisti sen. Kaikki kirjoittajat osallistuivat artikkeliin ja hyväksyivät toimitetun version.,
Rahoitus
tätä työtä tuki Korean kansallisen tutkimussäätiön (NRF) avustus, jota rahoitti Korean hallitus (MSIP) (No.NRF-2017R1C1B1006387) ja Korean Society of Ginseng (2019).
eturistiriita
kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.,terol; LH, Luteinising hormone; MCP, monocyte chemoattractant protein; MeSH, medical subject heading; mTOR, inhibit mammalian target of rapamycin; NF-κb, nuclear factor kappa B; NGF, nerve growth factor; p53, tumor suppressor p53; PCOS, polycystic ovary syndrome; PGE, prostaglandin E; PI3K, phosphoinositide3-kinase; SD, Sprague Dawley; SHBG, sex hormone binding globulin; TC, Total cholesterol; TG, Triglyceride; TGF, transforming growth factor; TNF, tumor necrosis factor; TUNEL, terminal deoxynucleotidyl transferase dUTP nick end labeling; VLDL-C, Very low density cholesterol; XYS, Xiao-Yao-San.,
Rotterdam ESHRE/ASRM-Sponsoroi PCOS Konsensus Työpaja Ryhmä (2004). Vuoden 2003 tarkistettu yksimielisyys munasarjojen monirakkulatautiin liittyvistä diagnostisista kriteereistä ja pitkäaikaisista terveysriskeistä. Hedelmällisyyssteriliteetti 81 (1), 19-25. doi: 10.1016 / j.fertnstert.2003.10.004
CrossRef Koko Teksti | Google Scholar
Semenova, I. (1969). Stein-Leventhalin syndrooman munasarjojen adrenerginen innervaatio. Vestnik Akademii Meditsinskikh Nauk SSR 24 (9), 58.
Google Scholar