Taitojen kehittämiseen,
- Ymmärtää, miksi Lavoisier on joskus kutsutaan ”Isä Nykyaikaisen Kemian”
- Erottaa tarkkuus tarkkuus
Joten mitä tapahtui puolestaan alkemia, joka oli kuin maaginen juoma -, panimo, Harry Potter, osaksi tieteen kemian? Se oli mittausta. Huolellinen, huolellinen määrien, kuten massojen, tilavuuksien, tiheyksien, lämpötilojen ja paineiden, mittaaminen.
varhainen mittauksen sankari oli Antoine Lavoisier., Hän oli ensimmäisiä todellisia kemian tutkijoita. Hän teki tarkkoja kokeita, eikä yrittänyt tehdä mitään johtopäätöksiä kuin mitä hänen tietonsa edellyttivät. Hän sanoi, että fakta, ajatus ja sana pitäisi yhdistää mahdollisimman tiiviisti: että kieltä ei voi parantaa parantamatta ajattelua, eikä ajattelua voi parantaa ilman kielen parantamista. Niinpä hän oli uranuurtaja järjestelmällisessä kemiallisessa nimikkeistössä, jota pääasiassa käytämme nykyään., Huomattavan, jos luet hänen tekstinsä, joka on kirjoitettu vuonna 1789, tarkoituksena on esitellä kemiaa aloittelijoille, suuri osa siitä on edelleen täysin ymmärrettävää ja jopa oikea nykyaikaisten standardien.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier ensin kuvataan valtioiden asia: kaasut, nesteet ja kiinteät aineet. Hän huomauttaa, kun kiinteää ainetta lämmitetään, se pyrkii laajentamaan, tulossa ensimmäinen neste, joka vie vakio määrä, mutta voidaan kaataa, toisin kuin kiinteä., Enemmän lämmitystä, ja se tulee kaasua, jota hän kuvailee joustava, koska se laajentaa tai tiivistää eri määriä riippuen paine. Toisin kuin kreikan filosofit, hän ymmärsi, että tämä on fyysinen muutos, ei kemiallisia muutoksia, ja hän on hyvä submicroscopic mittakaavan intuitio siitä, mitä tapahtuu: hiukkaset materiaali eivät muutu, he vain saada kauemmaksi toisistaan.,
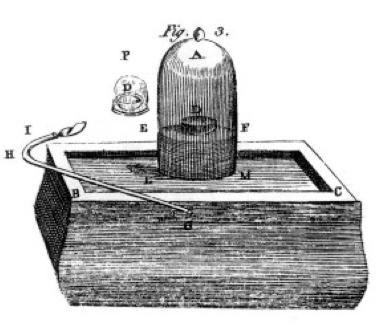
Hän paloi rikki ja fosfori ja hiili (hiilen) ja teki huolellista havaintoja, usein käyttäen bell jar yli ämpäri elohopeaa, kuten on esitetty piirustuksessa hänen kirja, Luku 1. Tämä on esimerkki kemiallisesta muutoksesta tai kemiallisesta reaktiosta, jossa reaktoivat kemikaalit muuttuvat eri tuotekemikaaleiksi. Jos sytytät d-merkityn astian rikin ilman kellopurkin alle, se palaa, kunnes se sammuu jättäen ylimääräistä rikkiä. Purkkiin jäävä ilma ei enää ole hyväksi hengitykselle. Jos laitat hiiren purkkiin, se kuolee, kuten liekki teki., Tämä osoittaa ajatuksen reaktantin rajoittamisesta. Reaktio tai palaminen loppui, kun siitä loppui happi, jolloin purkkiin jäi pääasiassa typpeä (ja muutama jälki muita kaasuja). Priestley, toinen tiedemies, näytti hänelle, miten valmistaa puhdasta happikaasua, ja hän käytti tätä myös monien polttavien kokeiden tekemiseen.
Lavoisier oli pakkomielle mittaus., Hän kehitti taidokkaan laitteen kaiken mittaamiseen. Hän polttaisi fosforia, kuten kuvassa 1 esitetään, ja tarkkailisi valkoisen hilseilevän tuotteen muodostumista. Fosfori (lähtöaineeseen tässä tapauksessa) ei ole vesiliukoista, mutta tuote oli, joten hän keräsi tuote erittäin huolellisesti, erottamalla se reagoimattoman fosforia pesemällä vedellä. Kuivauksen jälkeen, hän ei voinut mitata, kuinka paljon fosforia oli poltettu, kuinka paljon happea oli käytetty (koska hän tiesi, tiheys, hapen kaasu), ja kuinka paljon tuotetta oli muodostunut., Hän havaitsi, että tuotteen massa oli jokaisessa kokeessa kulutettujen reaktorin massojen summa. Tämä on laki massan säilyttämisestä (jota itse asiassa jotkut varhaisemmat alkemistit ja kemistit olivat myös käyttäneet). Hän myös huomautti, että fosfori ei ole makua, mutta tuote, jota hän kutsui fosforihappoa, on hapan. Hän tiesi, että näissä kokeissa, että monissa tapauksissa tekijöitä yhdistää vain tietyt mittasuhteet, ja myös, että happi voi yhdistää rikkiä, fosforia, jne kahdella eri suhteissa., Hän antoi meille terminologiaa, me silti käyttää tänään: rikkihappo muodostuu rikkiä ja enemmän happea, sulfurous acid koostuu rikkiä ja vähemmän happea. -ous tarkoittaa vähemmän happea. – ic tarkoittaa enemmän happea. Lisätietoja on nimikkeistön sivulla.
Lavoisier kiinnittänyt huomiota tarkkuutta ja täsmällisyyttä. Esimerkiksi kokeessa olemme juuri kuvattu, hän mitataan kaasun määrä bell jar, ennen ja jälkeen reaktion, mutta totesi, että reaktion jälkeen, sinun on odotettava, kunnes lämpötila palaa siihen, mitä se oli, kun mitattu alun perin., Jos kaasu on kuumaa, kun mittaat sen tilavuuden reaktion jälkeen, se on laajentunut, eikä vakiotiheyttäsi sovelleta. Tämä toisi mittauksiin systemaattisen virheen: joka kerta, kun suoritat kokeen, ajattelet, että kaasua jää enemmän kuin todellisuudessa on, eikä mittauksesi ole tarkka. Jos kokeen keskimääräinen tulos on lähellä oikeaa arvoa, se on tarkka. Kuitenkin, jos kokeilu antaa hyvin eri numeroita joka kerta, vaikka keskiarvo on oikea ja kokeilu on tarkka, se ei ole tarkka., Tarkkuus on ero kokouksessa ”noin kello 2″ ja kokouksessa ” 3 minuuttia ja 27 sekuntia ennen klo 2.”Tarkkuus on kuinka tarkka olet, kuinka paljon yksityiskohtia käytät. Lavoisier auttoi myös kehittämään Korean ja monien muiden maiden käytössä olevien yksiköiden järjestelmää (kg, L, m).

Yleistä, vaikka hän ei tehnyt hyvin paljon alkuperäisen kokeiluja, että kukaan muu ei ollut tehnyt ennen, hän teki kokeiluja erittäin huolellisesti, joten ne olivat yhtä tarkka ja täsmällinen kuin mahdollista, ja sitten hän ajatteli niitä selvästi ja loi sanoja kuvaamaan kemikaalien ja ideoita, jotka auttoivat tekemään kaiken selkeämpi., Jos luet ennen Lavoiseria kirjoitetun kemian oppikirjan, olet hyvin hämmentynyt, koska kemikaalien nimet perustuisivat historiaan (ja kuulostaisivat kuin ne olisivat peräisin Harry Potterista) sen sijaan, että ne perustuisivat siihen, mitä kemikaalit ovat. Jos luet Lavoiserin jälkeen kirjoitetun kemian tekstin, tunnistat kielen samanlaiseksi kuin nykyään.
Tiivistelmä
Tarkkuus kuvaa, kuinka lähellä mitattu arvo on todellista arvoa. Tarkkuus kuvaa, kuinka hyvin joukko mitattuja arvoja on keskenään samaa mieltä., Massan säilymislaissa todetaan, että ainetta ei voida luoda eikä tuhota kemiallisella tai fyysisellä prosessilla. Tämä johtaa siihen, että missä tahansa kokeessa kulutettujen reaktorin massojen summa on yhtä suuri kuin tuotteen massa. Kemiallisiin muutoksiin liittyy aineen kemiallisen identiteetin muuttaminen siten, että muodostuu uusia aineita. Fysikaalisiin muutoksiin kuuluu aineen muuttaminen muuttamatta sen kemiallista identiteettiä. Palaminen ja ruostuminen ovat kaksi esimerkkiä kemiallisista prosesseista, kun taas kiehuminen ja sulaminen ovat esimerkkejä fysikaalisista prosesseista., Kemiallisia reaktioita liittyy kääntämällä reagenssit, kemikaalit, jotka saavat kulutetaan prosessissa kemiallisia muutoksia, osaksi tuotteita, kemikaaleja tuotetaan prosessin läpi kemiallisia muutoksia, joilla on erilainen koostumus reagenssit. Rajoittava reaktantti määrittää tai rajoittaa tuotteen määrää, joka voidaan valmistaa kemiallisesta reaktiosta.
Ulkopuolella Linkkiä
- CrashCourse Kemia: peruslaki (11 min)
Avustajat ja Attribuutiot
-
Emily V Eames (City College of San Francisco)