Færdigheder til at Udvikle
- Forstå, hvorfor Lavoisier er nogle gange kaldt “Faderen til Moderne Kemi”
- Skelne nøjagtigheden af præcision
hvad skete der Så til gengæld alkymi, der var ligesom magiske drik,-brygning i Harry Potter, i videnskaben om kemi? Det var måling. Omhyggelig, omhyggelig måling af mængder, såsom masser, volumener, densiteter, temperaturer, tryk.
en tidlig målehelt var Antoine Lavoisier., Han var en af de første sande kemiske forskere. Han gennemførte omhyggelige eksperimenter og forsøgte ikke at drage nogen konklusioner undtagen dem, der kræves af hans data. Han sagde faktisk, idé, og ordet skal være så tæt forbundet som muligt: at du ikke kan forbedre dit sprog uden at forbedre din tankegang, og du kan ikke forbedre dine tanker uden at forbedre dit sprog. Så han var banebrydende for en systematisk kemisk nomenklatur, der i det væsentlige er det, vi bruger i dag., Bemærkelsesværdigt, hvis du læser hans tekst, skrevet i 1789, beregnet til at introducere kemi til begyndere, er meget af det stadig helt forståeligt og endda korrekt efter moderne standarder.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier første beskriver tilstandsformer: gasser, væsker og faste stoffer. Han påpeger, når et fast materiale opvarmes, har det en tendens til at ekspandere og bliver først en væske, der optager et konstant volumen, men kan hældes, i modsætning til et fast stof., Mere opvarmning, og det bliver en gas, som han beskriver som elastisk, fordi den vil udvide eller komprimere til forskellige volumener afhængigt af trykket. I modsætning til de græske filosoffer forstod han, at dette er en fysisk ændring, ikke en kemisk ændring, og han har en god submikroskopisk skala intuition af, hvad der sker: materialets partikler ændrer sig ikke, de kommer bare længere fra hinanden.,
han brændte svovl og fosfor og trækul (kulstof) og gjorde omhyggelige observationer, ofte ved hjælp af klokkekrukken over en spand kviksølv som vist på tegningen fra hans bog, Figur 1. Dette er et eksempel på en kemisk ændring eller kemisk reaktion, hvor reaktantkemikalier bliver til forskellige produktkemikalier. Hvis du tænder svovlet i skålen mærket D under klokkebeholderen med luft, brænder det, indtil det går ud og efterlader noget ekstra svovl. Den resterende luft i krukken er ikke længere god til vejrtrækning. Hvis du lægger en mus i krukken, vil den dø, ligesom flammen gjorde., Dette demonstrerer begrebet begrænsende reaktant. Reaktionen eller brændingen stoppede, da den løb tør for ilt, hvilket primært efterlod nitrogen (og et par spor andre gasser) i krukken. Priestley, en anden videnskabsmand, viste ham, hvordan man forbereder ren iltgas, og han brugte dette til at gøre mange brændende eksperimenter samt.
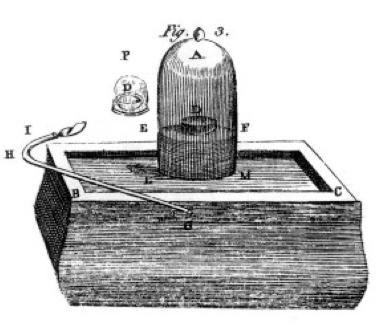
Lavoisier var besat med måling., Han udviklede detaljerede apparater til måling af alt. Han ville brænde fosfor, som vist i Figur 1, og observere dannelsen af et hvidt flassende produkt. Fosfor (reaktant-i dette tilfælde) ikke vandopløseligt, men produktet var, så han indsamlede produktet meget omhyggeligt, der adskiller det fra uomsat fosfor ved at vaske med vand. Efter tørring kunne han måle, hvor meget fosfor der var brændt, hvor meget ilt der var forbrugt (fordi han vidste tætheden af iltgas), og hvor meget produkt der var dannet., Han fandt, at massen af produktet var summen af masserne af reaktant forbruges, i hvert eksperiment. Dette er loven om bevarelse af masse (som faktisk nogle tidligere alkymister og kemikere også havde brugt). Han observerede også, at fosforet ikke har nogen smag, men produktet, som han kaldte fosforsyre, er surt. Han vidste fra disse eksperimenter, at elementer i mange tilfælde kun kombinerer visse proportioner, og også at ilt kan kombinere med svovl, fosfor osv., Han gav os den terminologi, vi stadig bruger i dag: svovlsyre består af svovl og mere ilt, svovlsyre består af svovl og mindre ilt. – ous betyder mindre ilt ;- IC betyder mere ilt. Se siden nomenklatur for detaljer.
Lavoisier var meget opmærksom på nøjagtighed og præcision. For eksempel, i det eksperiment, vi lige har beskrevet, han målte mængden af gas i den glasklokke, før og efter reaktionen, men bemærkede, at efter den reaktion, skal du vente, indtil temperaturen vender tilbage til hvad den var, da du målte oprindeligt., Hvis gassen er varm, når du måler dens volumen efter reaktionen, vil den være udvidet, og din standarddensitet gælder ikke. Dette ville introducere en systematisk fejl i målingerne: hver gang du udfører eksperimentet, vil du tro, at der er mere gasrester, end der faktisk er, og din måling vil ikke være nøjagtig. Hvis det gennemsnitlige resultat af dit eksperiment er nær den korrekte værdi, er det nøjagtigt. Men hvis dit eksperiment giver meget forskellige tal hver gang, selvom gennemsnittet er korrekt, og eksperimentet er nøjagtigt, er det ikke præcist., Præcision er forskellen mellem møde “omkring 2 klokken” og møde ” på 3 minutter og 27 sekunder før 2 pm.”Præcision er, hvor specifik du er, hvor mange detaljer du bruger. Lavoisier hjalp også med at udvikle systemet med enheder (kg, l, m), der i øjeblikket er i brug i Korea og mange andre lande.

Samlet, mens han gjorde ikke mange originale eksperimenter, som ingen andre havde gjort før, han gjorde, hans eksperimenter, meget omhyggeligt, så de var så præcise og nøjagtige som muligt, og så er han tænkte om dem klart og skabte ord til at beskrive de kemikalier og ideer, der hjalp med at gøre alt klarere., Hvis du læser en kemi, lærebog skrevet før Lavoiser, vil du blive meget forvirret, fordi de navne, for kemikalier vil være baseret på historie (og ville lyde, som om de kom fra Harry Potter), snarere end at være baseret på, hvad de kemikalier, der er. Hvis du læser en Kemi tekst skrevet efter Lavoiser, vil du genkende sproget som ligner det, vi bruger i dag.
resum.
nøjagtighed beskriver, hvor tæt en målt værdi er på den faktiske værdi. Præcision beskriver, hvor godt en gruppe af målte værdier er enige med hinanden., Loven om bevarelse af masse siger, at materie hverken kan skabes eller ødelægges ved en kemisk eller fysisk proces. Dette resulterer i summen af masserne af reaktant forbruges i ethvert forsøg er lig med massen af produktet. Kemiske ændringer indebærer at ændre et stofs kemiske identitet, således at nye stoffer dannes. Fysiske ændringer indebærer at ændre et stof uden at ændre dets kemiske identitet. Forbrænding og rustning er to eksempler på kemiske processer, mens kogning og smeltning er eksempler på fysiske processer., Kemiske reaktioner involverer at omdanne reaktanter, kemikalier, der forbruges i processen med kemisk ændring, til produkter, kemikalier produceret gennem processen med kemisk ændring, der har en anden sammensætning end reaktanterne. En begrænsende reaktant bestemmer eller begrænser mængden af produkt, der kan fremstilles ved en kemisk reaktion.
Uden for Link
- CrashCourse Kemi: Den Grundlæggende Lov (11 min.)
Bidragydere og Kategorier
-
Emily V Eames (City College of San Francisco)